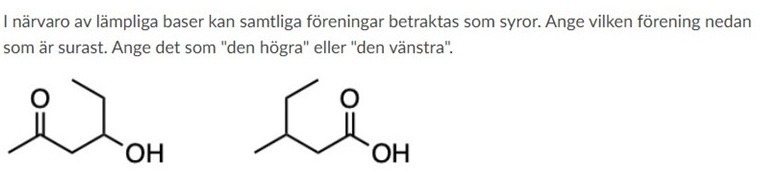
Vilken förening är surast?
Hej,
Jag har väldigt svårt avgöra vilken förening som är surast. Å ena sidan binder den högra föreningen en karboxygrupp på kol 1 vilken är mer elektrondonernade än acetylgruppen på motsvarande kol i den vänstra föreningen. Samtidigt är butylgruppen på kol 2 i den högre föreningen mindre elektrondonerande än propanolgruppen på den vänstra. De ligger dessutom på ett lika stort avstång från varandra vilket för det svårt för mig att avgöra vilken effekt som väger tyngst.
Visa spoiler
Intuitivt tänker jag att den högra föreningen är surast då karboxygruppen primärt har en elektrondragande effekt även om OH-gruppen gör den något mindre dragande än acetylgruppen.
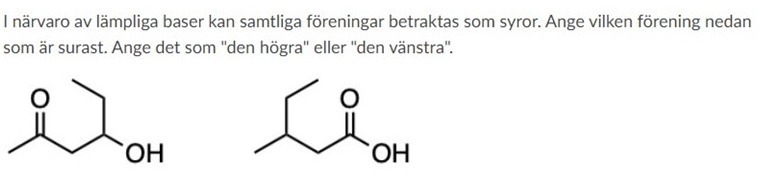
Blåvalen skrev:Hej,
Jag har väldigt svårt avgöra vilken förening som är surast. Å ena sidan binder den högra föreningen en karboxygrupp på kol 1 vilken är mer elektrondonernade än acetylgruppen på motsvarande kol i den vänstra föreningen. Samtidigt är butylgruppen på kol 2 i den högre föreningen mindre elektrondonerande än propanolgruppen på den vänstra. De ligger dessutom på ett lika stort avstång från varandra vilket för det svårt för mig att avgöra vilken effekt som väger tyngst.
Visa spoiler
Intuitivt tänker jag att den högra föreningen är surast då karboxygruppen primärt har en elektrondragande effekt även om OH-gruppen gör den något mindre dragande än acetylgruppen. Att OH på den vänstra föreningen inte skyms av någon dubbelbidning gör den starkt donerande.
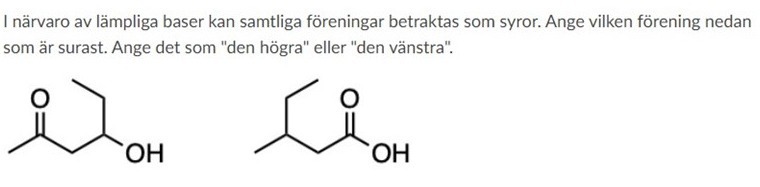
Blåvalen skrev:Hej,
Jag har väldigt svårt avgöra vilken förening som är surast. Å ena sidan binder den högra föreningen en karboxygrupp på kol 1 vilken är mer elektrondonernade än acetylgruppen på motsvarande kol i den vänstra föreningen.
Nej karboxylgruppen är inte elektrondonerande - tvärt om den är elektrondragande!
Syreatomerna är de mest elektronegativa i föreningen och drar till sig både elektronerna ifrån vätet i karboxylgruppen, men drar även till sig elektronerna i bindningarna till kol1. I princip skapas en induktiv effekt i hela molekylen ifrån syrena, vilket surgör resten av protonerna - men endast en till en begränsad del.
Samtidigt är butylgruppen på kol 2 i den högre föreningen mindre elektrondonerande än propanolgruppen på den vänstra. De ligger dessutom på ett lika stort avstång från varandra vilket för det svårt för mig att avgöra vilken effekt som väger tyngst.
Visa spoiler
Intuitivt tänker jag att den högra föreningen är surast då karboxygruppen primärt har en elektrondragande effekt även om OH-gruppen gör den något mindre dragande än acetylgruppen.
Syreatomerna är de som du behöver fokusera på, när det gäller elektrondragande. Syreatomerna behöver dessutom kunna hålla den resulterande negativa laddningen.
I föreningen till vänster, ligger syreatomerna i varsin ände av molekylen, och drar elektronerna åt båda hållen, d.v.s. deras elektrondragande balanseras.
För att hitta svaret på vilken förening som är surast behöver du utgå ifrån, vilken grupp skulle vara bäst på att lagra den extra elektronen som fås efter att basen tar protonen, alkoholen/ketonen, eller karboxylgruppen?
Nej karboxylgruppen är inte elektrondonerande - tvärt om den är elektrondragande!
Det vet jag, men man måste ju jämföra hur elektrondragande karbonylsyrena är i realtion till varandra. I och med att det i den högra föreningen finns en OH-grupp som är starkt elektrondonernade (det finns ett fritt elektronpar som kan resonera) så förvagas den elektrondragen effekten.
I föreningen till vänster, ligger syreatomerna i varsin ände av molekylen, och drar elektronerna åt båda hållen, d.v.s. deras elektrondragande balanseras.
Intressant aspekt, men kom ihåg att OH-gruppen är elektrondonerande grupp som är avsevärt bättre än alkylgruppen på detta. Kan man kanske tolka det som att ''krafterna tar ut varandra''. Isåfall blir jag ändå osäker på hur bra man kan lagra en elektron där.
Blåvalen skrev:Nej karboxylgruppen är inte elektrondonerande - tvärt om den är elektrondragande!
Det vet jag, men man måste ju jämföra hur elektrondragande karbonylsyrena är i realtion till varandra. I och med att det i den högra föreningen finns en OH-grupp som är starkt elektrondonernade (det finns ett fritt elektronpar som kan resonera) så förvagas den elektrondragen effekten.
Nej du behöver inte jämföra karbonylsyrena med varandra.
I föreningen till vänster ligger karbonylsyret två kol bort från den suraste protonen i hydroxigruppen, där kolen i mitten dämpar elektrondragandet.
Medans i karboxylsyran, sitter både karbonyl- och hydroxigrupperna ihop. Och efter protolysering, kommer den resterande elektronen effektivt delokaliseras mellan båda syrena genom kolatomen i mitten. För dessa atomer bildas ett gemensamt pi-system, precis som i en vanlig karboxylsyra. Och i detta delokaliserade pi-system kommer elektronen vara rätt nöjd, jämfört med om elektronen skulle sitta på en (ganska) isolerad syreatom, som ensamt skall hålla den extra elektronen från att återigen ta upp en proton.
I föreningen till vänster, ligger syreatomerna i varsin ände av molekylen, och drar elektronerna åt båda hållen, d.v.s. deras elektrondragande balanseras.
Intressant aspekt, men kom ihåg att OH-gruppen är elektrondonerande grupp som är avsevärt bättre än alkylgruppen på detta. Kan man kanske tolka det som att ''krafterna tar ut varandra''. Isåfall blir jag ändå osäker på hur bra man kan lagra en elektron där.
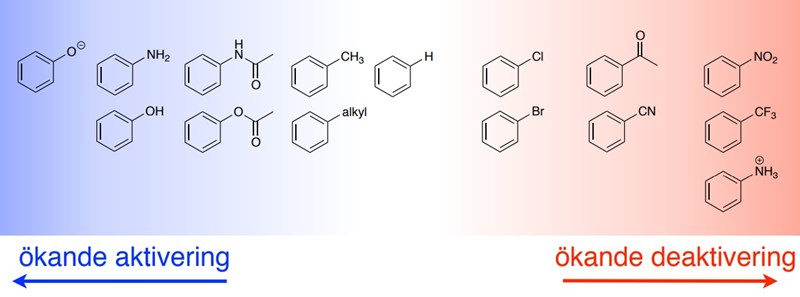
Figuren anger hur reaktionsbenägen atomerna i ringen är, d.v.s. hur mycket mer eller mindre reaktionsbenägna dessa atomer är, jämfört med bensen. Det blir lite annorlunda i ditt fall, då pi-system saknas, och det istället är en protonavgång.
Jag kanske skulle varit tydligare med att jag med "elektrondragande", menade polarisering av elektrontätheten, d.v.s. att de mer elektronegativa atomerna/grupperna kommer dra i de närliggande elektronerna, inklusive bindningarna till 3,4 i föreningen till höger. Men då syreatomerna i föreningen till vänster drar från varsin sida av molekylen, utjämnas detta elektrondragande. Med det menade jag att elektrondragandet inte var en faktor som spelade så stor roll i detta sammanhang, då effekten på bindningen till det respektive sura vätet blir så liten.
mag1 skrev:Jag kanske skulle varit tydligare med att jag med "elektrondragande", menade polarisering av elektrontätheten, d.v.s. att de mer elektronegativa atomerna/grupperna kommer dra i de närliggande elektronerna, inklusive bindningarna till 3,4 i föreningen till höger. Men då syreatomerna i föreningen till vänster drar från varsin sida av molekylen, utjämnas detta elektrondragande. Med det menade jag att elektrondragandet inte var en faktor som spelade så stor roll i detta sammanhang, då effekten på bindningen till det respektive sura vätet blir så liten.
Just det - den där bilden är kanske mest atuell för en elektrofil aromatisk substituion! Dock vet jag inte vilken effekt utjämnandet har i den vänstra föreningen. Det låter väldigt stabilt, men mest gynnsamt är det ju om en elektron kan avlastas av en elektrondragande grupp. I den högra föreningen har vi både en elektrondragande och en egentligen svagt donerande grupp. Den föreningen börde väl då vara surast.
Den högra föreningen ser helt klart surare ut, inte enbart för att karboxygruppen mer effektivt drar till sig bindningselektronerna, till det sura vätet.
Den korresponderande basen i karboxylsyran (R-COO-) är dessutom betydligt svagare, än motsvarande i föreningen till vänster (R-O-), i princip en etoxidjon (en stark bas). Ketogruppen påverkar detta en aning, så denna bas är inte lika stark som t.ex. etoxiden.
Du kanske redan reflekterat över det, men föreningen till vänster är lik de aldolkondensationsprodukter du frågat om tidigare. Den har fri rotation över alla bindningar frånsett dubbelbindningen. Så om du tänker dig rotation längs bindningen mellan kol3-4, så kommer de bägge syrena ganska nära varandra, borde vara under 3Å.