Vilket ämne bildas i störst mängd? Reaktionshastighet...
Hej, jag vet inte hur jag ska tänka i denna uppgift:
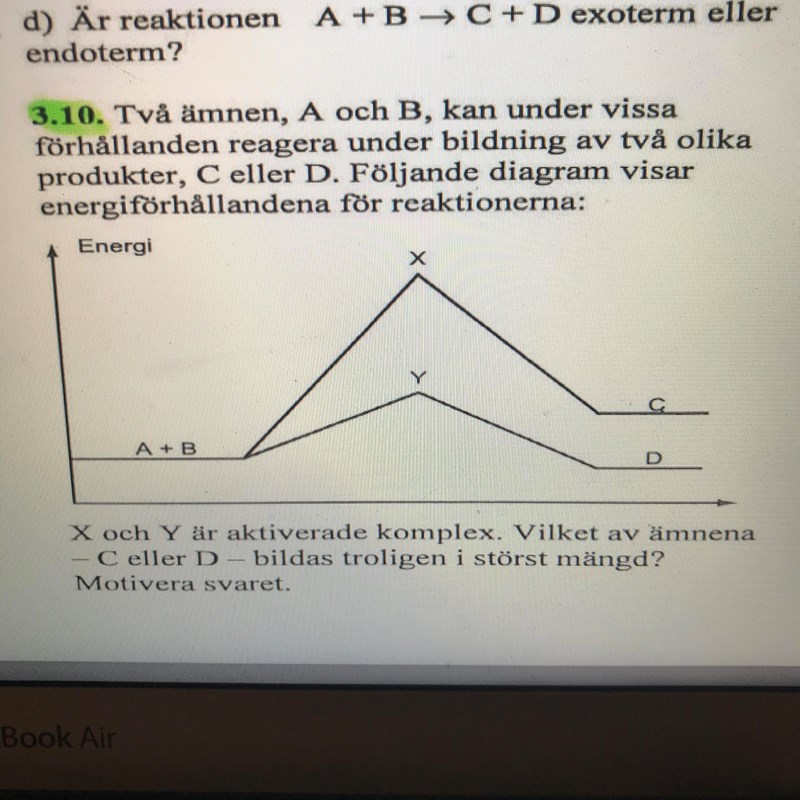
Om tusen personer skulle ta varandra hand i hand och vandra över en kulle (Y) eller ett högt berg (X), i vilket av fallen skulle flest lyckas? I grund och botten är det samma princip. Molekylerna måste ha mycket högre energi och kollidera med högre kraft för att ta sig över barriären X jämfört med Y. Det är därför mer troligt att de tar sig över Y men inte X.
Det är svaret om man bara tar hänsyn till reaktionshastigheten, men man kan tolka frågan som ”i vilket av fallen bildas det mest produkt när jämvikt har nåtts”. Hur skulle det bli i det fallet?
Teraeagle skrev :Om tusen personer skulle ta varandra hand i hand och vandra över en kulle (Y) eller ett högt berg (X), i vilket av fallen skulle flest lyckas? I grund och botten är det samma princip. Molekylerna måste ha mycket högre energi och kollidera med högre kraft för att ta sig över barriären X jämfört med Y. Det är därför mer troligt att de tar sig över Y men inte X.
Det är svaret om man bara tar hänsyn till reaktionshastigheten, men man kan tolka frågan som ”i vilket av fallen bildas det mest produkt när jämvikt har nåtts”. Hur skulle det bli i det fallet?
okej tack för svaret för reaktionshastigheten. :)
Nu till jämvikt som också är en väldigt bra fråga. När jämvikt nås kommer reaktionshastigheten för bildandet av produkt C och produkt D i respektive reaktion att vara lika stor för bildandet av produkterna och sönderfallet av de så att man får reaktanterna A + B igen. När jämvikt nås borde det inte vara lika mycket av både produkterna eftersom reaktionshastigheten är lika stor?
Det stämmer att det inte sker någon nettoproduktion eller konsumtion av reaktanter och produkter vid jämvikt, men man kommer nog att ha mer D även i det här fallet. Känner du till Gibbs fria energi? Det säger att reaktioner som ger en större sänkning av entalpin och större ökning av entropin är mer spontana. Du kan läsa av i diagrammet att energin (d.v.s. entalpin) faktiskt ökar när man bildar C, medan den sjunker något om man bildar D. Man kan uppskatta entropiändringen genom att se hur antalet partiklar ändras. I båda fallen tar vi två partiklar och bildar en, så entropiskillnaden bör vara ungefär lika stor (under antagandet att både C och D har samma aggregationstillstånd). Totalt sett innebär det att bildning av D är mer spontant och man kan förvänta sig att det bildas mer D jämfört med C när jämvikt har nåtts.
Teraeagle skrev :Det stämmer att det inte sker någon nettoproduktion eller konsumtion av reaktanter och produkter vid jämvikt, men man kommer nog att ha mer D även i det här fallet. Känner du till Gibbs fria energi? Det säger att reaktioner som ger en större sänkning av entalpin och större ökning av entropin är mer spontana. Du kan läsa av i diagrammet att energin (d.v.s. entalpin) faktiskt ökar när man bildar C, medan den sjunker något om man bildar D. Man kan uppskatta entropiändringen genom att se hur antalet partiklar ändras. I båda fallen tar vi två partiklar och bildar en, så entropiskillnaden bör vara ungefär lika stor (under antagandet att både C och D har samma aggregationstillstånd). Totalt sett innebär det att bildning av D är mer spontant och man kan förvänta sig att det bildas mer D jämfört med C när jämvikt har nåtts.
är det då såhär att bildandet av D är en exoterm reaktion och bildandet av C är en endoterm reaktion och på grund av att bildandet av D är spontant bildas det mer utav produkten D?
detrr skrev :Teraeagle skrev :Det stämmer att det inte sker någon nettoproduktion eller konsumtion av reaktanter och produkter vid jämvikt, men man kommer nog att ha mer D även i det här fallet. Känner du till Gibbs fria energi? Det säger att reaktioner som ger en större sänkning av entalpin och större ökning av entropin är mer spontana. Du kan läsa av i diagrammet att energin (d.v.s. entalpin) faktiskt ökar när man bildar C, medan den sjunker något om man bildar D. Man kan uppskatta entropiändringen genom att se hur antalet partiklar ändras. I båda fallen tar vi två partiklar och bildar en, så entropiskillnaden bör vara ungefär lika stor (under antagandet att både C och D har samma aggregationstillstånd). Totalt sett innebär det att bildning av D är mer spontant och man kan förvänta sig att det bildas mer D jämfört med C när jämvikt har nåtts.
är det då såhär att bildandet av D är en exoterm reaktion och bildandet av C är en endoterm reaktion och på grund av att bildandet av D är spontant bildas det mer utav produkten D för att den inte behöver konstant tillförsel av energi?
Ja, så kan man se det. Om man höjde temperaturen skulle bildandet av C gynnas betydligt mer jämfört med D. Fler partiklar skulle ha hög energi, vilket ökar sannolikheten att de tar sig över barriären X. Det snabbar på reaktionshastigheten väsentligt. Eftersom bildandet av C är en endoterm reaktion gynnas det också av en högre temperatur jämviktsmässigt, medan bildandet av D missgynnas.
okej, tack så hemskt mycket för hjälpen och det andra perspektivet ang jämvikt ... det fick mig verkligen att tänka till :DDDDDDDD



