Zinksulfat
Hej!
Jag har lite svårt att förstå den här frågan.
1. 2,000g kristalliserat zinksulfat upphettades så att kristallvattnet gick bort. Saltets massa minskade då med 0,877g. Bestäm substansmängden vatten som finns för varje mol vattenfritt zinksulfat och skriv formeln för det kristalliserade zinksulfatet?
Jag förstår att man först behöver beräkna substansmängden för zinksulfat och då har jag gjort som bilden nedan. Dock så förstår jag inte hur vattnet kan försvinna överhuvudtaget när zinksulfatet är i en kristallform, då finns det väl inget vatten.
Tack på förhand!
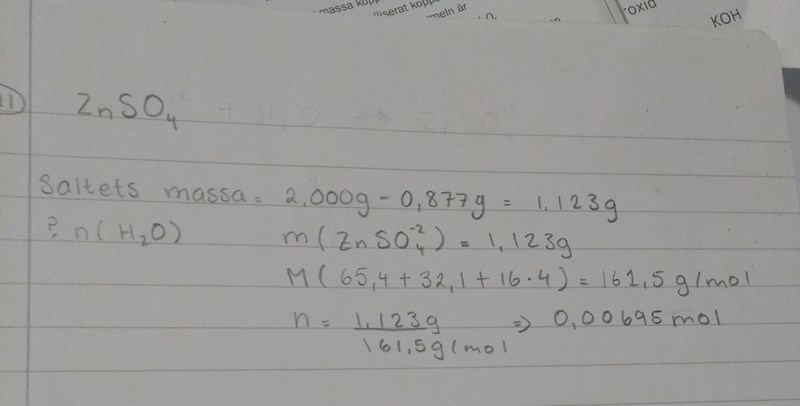
När man löser saltet i vatten så kommer vattenmolekylerna att attraheras av jonernas laddning. När man sen låter vattnet avdunsta från lösningen så kan en del molekyler ”sitta kvar” på jonerna, även när det har kristalliserats ut. Man brukar kalla vattnet för ”kristallvatten”. Om det är n stycken molekyler som sitter kvar så brukar man skriva det som där ditt uppdrag är att bestämma n. När mam upphetta saltet så kommer allt vatten att avgå som ånga, medan man får kvar det vattenfria saltet (”anhydrat”) .
Många jonföreningar, särskillt sulfater kan forma så kallade hydrat (hydro=vatten) vilket är kristaller som består både av jonföreningen och vattenmolekyler inbäddade i den fasta kristallstrukturen.
Dessa hydrat bildas ofta när kristallen fälls ut från en vattenlösning när vattnet ångar bort, men där en del av vattnet fastnar i kristallen istället för att avdunstas vid rumstemperatur. Det klassiska exemplet är kopparsulfat som när det bildas från avdunstning av en vatenlösning bildar en blå förening som kallas
Koppar(II)sulfatpentahydrat vilket är en förening CuSO4 ·5H2O där penta/femman betecknar att det för varje kopparjon i föreningen finns fem vattenmolekyler inbakade i strukturen. Dessa inbakade vattenmolekyler är bundna i kristallen vid rumstemperatur men kan drivas ut den vid upphettning.
Detta är en extremt vacker gif om vad som händer med kopparsulfatpentahydrat när det hettas till några hundra grader. https://chemlegin.files.wordpress.com/2013/01/dryingcuso4.gif
Vattnet avdunstas från kristallen och lämnar vattenlöst koppar(II)sulfat dvs CuSO4 utan någon H2O.
I ditt problem har samma sak skett fast med något zinksulfathydrat istället för med ett kopparsulfathydrat.
Vad du vill bestämma i ditt problem är hur många vattenmolekyler som är bundna i kristallen per zink-jon dvs finna vad n ska vara i formeln
Du vet redan substansmängden av vatten så jämför nu detta med substansmängden av Zink/Xinksulfat.




