5.23 oxidationstal
Hej! Resktionsformel i facit är inte balanserad och varför ändrar kol oxidationstal?
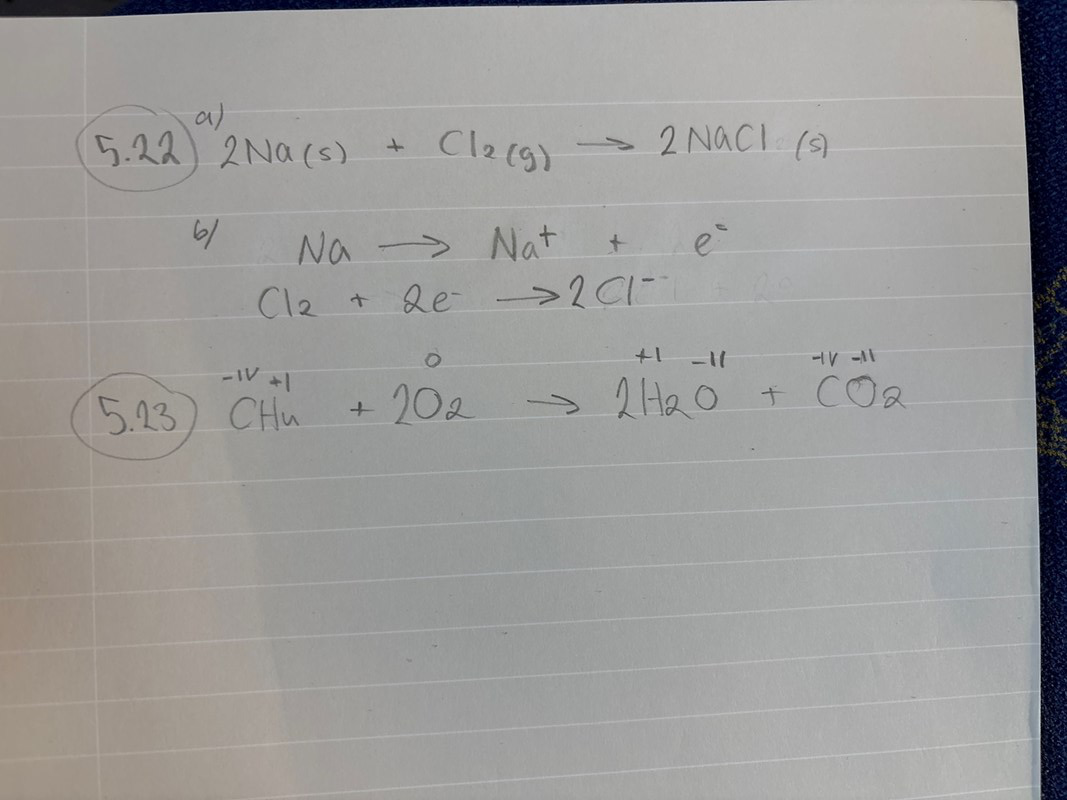

Vad står det i facit?
Din anteckning ser balanserad ut.
C kommer att gå från -IV till +IV (i CO2). Det oxideras, avger elektroner.
O går från 0 till -II (i H2O och CO2). Det reduceras, tar upp elektroner.
I facit står det
 Och hur vet jag att C ändrat laddning. Jag trodde alla atomer har samma oxidationstal om de inte är grundämnen då är de noll och inte laddningar för då ska summan av alla oxidationstal bli laddningen. Men hur skulle jag veta att C ändrar oxidationstal. Det är inte förens efter man ser oxidationstalen som man kan veta att det oxiderar
Och hur vet jag att C ändrat laddning. Jag trodde alla atomer har samma oxidationstal om de inte är grundämnen då är de noll och inte laddningar för då ska summan av alla oxidationstal bli laddningen. Men hur skulle jag veta att C ändrar oxidationstal. Det är inte förens efter man ser oxidationstalen som man kan veta att det oxiderar
Du är väldigt nära sanningen.
För det första är oxidationstal inte samma sak som laddning. Oxidationstal är ett tal som tilldelas varje atom eller atomjon efter vissa regler. Det används för att undersöka om ett ämne oxideras eller reduceras i en redoxreaktion.
Det finns regler för detta som IUPAC ställt upp:
- Oxidationstalet för ett grundämne är =0.
- För en atomjon är oxidationstalet samma som dess laddning.
- Väte har +1 och syre har -2 i de allra flesta kemiska föreningar, med några undantag.
- Summan av oxidationstalen i en neutral molekyl måste vara =0. Summan av oxidationstalen i en jon måste vara lika med dess laddning.
Vi har dessa regler i åtanke och kikar på metan CH4:
- regel #3 säger att H har OT +I
- regel #4 säger att summan måste vara =0
- ... så C måste ha OT -IV
Sedan tar vi syrgas O2:
- regel #1 säger att O har OT 0
- (det säger även regel #2)
- ... så O måste ha OT 0
Nu kikar vi på produktsidan och börjar med koldioxid CO2:
- regel #3 säger att O har OT -II
- regel #4 säger att summan skall vara 0
- ... så C måste ha OT +IV
Vattnet är inte så spännande, men ändå:
- regel #3 säger egentligen allt
- regel #4 säger att summan skall vara noll
Det är med hjälp av oxidationstalet som vi nu kan konstatera att kol har oxiderats.
Sedan har inte facit balanserat reaktionsformeln, men det är inte så intressant eftersom man inte frågar efter substansmängder eller sådant.
Vet inte om det blev klarare så här, annars fortsätt fråga.
tusen tusen tack!
det här hjälpte otroligt mkt, tack igem
Oxidationstal är alltså en rent mänsklig konstruktion och ingenting som „finns“ på samma sätt som en elektron eller en proton finns! Det finns ingenting i naturen som säger att väte i H2O2 har (genomsnittligt) „oxidationstal +II“.
Ha en fin dag skrev:det här hjälpte otroligt mkt, tack igem
Alltid roligt när man kan vara till hjälp! Fråga på ...



