Alkohol, eter eller alkan
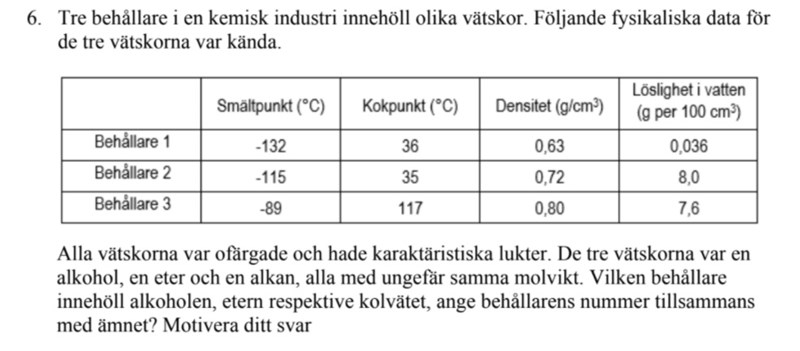
Behållare 1 bör vara alkanen eftersom de är opolära. Men hur kan den ha en högre kokpunkt än etern som jag tror finns i behållare två. Eter är polära och kan lösa sig med vatten, men kan eter verkligen lösa sig i vatten bättre än alkohol. Det som är kvar för behållare 3 är då alkohol, det verkar vara rätt enligt dess kokpunkt, men hur har den en mindre löslighet i vatten än eter. För mig går detta verkligen inte ihop.
Gulnigar_yeye skrev:
Behållare 1 bör vara alkanen eftersom de är opolära. Men hur kan den ha en högre kokpunkt än etern som jag tror finns i behållare två.
Skillnaden är endast en grad. Så om (1) har en längre kolkedja än (2) kan det göra att det finns flera av de svagare van der Wahls-bindningarna, som tillsammans gör kokpunkten aningen högre.
Eter är polära och kan lösa sig med vatten, men kan eter verkligen lösa sig i vatten bättre än alkohol. Det som är kvar för behållare 3 är då alkohol, det verkar vara rätt enligt dess kokpunkt, men hur har den en mindre löslighet i vatten än eter. För mig går detta verkligen inte ihop.
Här är skillnaden i löslighet ganska liten skillnad (5%). Och denna skillnad kan vara ett resultat av att (3) har en längre kolkedja än (2). Så trots att (3) som du misstänker är alkoholen har starkare bindningar (vätebindningar) än din föreslagna eter (2), så kan skillnaden i kolkedjans längd förklara skillnaden i löslighet. Lösligheten är ett resultat av både faktorer som ökar lösligheten (skapandet av vätebindningar), och motverkande faktorer (som en kolkedja).
Okej, så jag gör rimliga antaganden om jag säger att (1)= alkanen, (2)= Etern, (3)= Alkoholen.
Men hur kommer det sig att etern har så hög löslighet men en låg kokpunkt? Eter kan väl endast bindas med VDW-bindningar, vilket förklarar dess låga kokpunkt. Men hur kan den lösa sig i vatten om den är opolär? Är det vätet i vattnet som binder sig till syret i etergruppen och därmed binder sig med den?
Etern är relativt polär, speciellt om det är en eter med kortare kolkedjor som t.ex. dietyleter. Etern kan bilda vätebindningar till vatten (endast som vätebindningsacceptor dock, då etrar inte har någon hydroxigrupp att donera en vätebindning ifrån). Men den har två stycken tvåkolskedjor, som inte vill vara i vattnet. Dock är vätebindningarna en så mycket starkare kraft, jämfört med vattnets ovilja mot att lösa kolkedjorna, så etern är ganska vattenlöslig - eftersom syreatomen bidrar till att göra molekylen polär (d.v.s. laddningsfördelningen är inte jämt fördelad över molekylen).
Kommer inte deltaladdningarna som bildas av syremolekylen sammanfalla på samma punkt så att den inte blir en dipol?
Gulnigar_yeye skrev:Kommer inte deltaladdningarna som bildas av syremolekylen sammanfalla på samma punkt så att den inte blir en dipol?
Om det handlar om etrar: Nej, eftersom molekylen (förenklat) är formad som ett V med syret i spetsen.
Innebär det då att etrar kan binda sig med dipol-dipolbindningar? I så fall borde väl dess kokpunkt vara högre än alkanens som endast binds med VDW-bindning.
Bindningarnas styrka mellan molekyler, som en eter, är en summa av alla attraherande interaktioner (vätebindningar om vatten finns med, dipol, van der Waals), minus repellerande krafter. Så ja, dipol-liknande interaktioner kan ske, men vätebindningarna är så pass mycket starkare att dipol-bindningarna inte påverkar kokpunkten.



