Beräkna löslighetsprodukt
Hej!
 På uppgiften ovan har jag kommit såhär långt:
På uppgiften ovan har jag kommit såhär långt:
n(Ag2CrO4) = 0,0301/((108×2)+52+(16×4)) = 9,066265 mol
I facit står det att silverkromatens löslighetsprodukt är: 3,0 * 10^(-12) M^3
Tack på förhand!
1. Du har räknat fel med en massa tiopotenser!
2. Vet du vad löslighetsprodukt är? Du behöver beräkna koncentrationen av silverjoner och kromatjoner!
Här var det en hel del som var lite konstigt.
Börja med att beräkna molmassan för silkverkromat.
Smaragdalena skrev:Här var det en hel del som var lite konstigt.
Börja med att beräkna molmassan för silkverkromat.
M=108×2 + 52 + 16×4 = 332
Och nu? :)
SvanteR skrev:1. Du har räknat fel med en massa tiopotenser!
2. Vet du vad löslighetsprodukt är? Du behöver beräkna koncentrationen av silverjoner och kromatjoner!
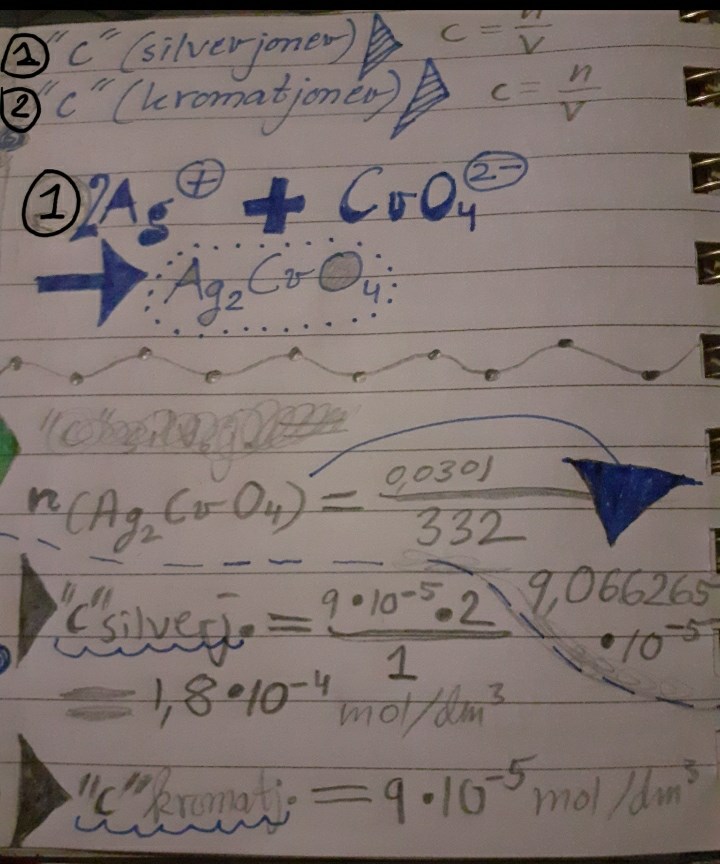
Då vet du att 1 mol silverkromat har massan 332 g. Hur många mol är 0,0301 g silverkromat?
Tack Smaragdalena att Du hjälper även under påsk! Vad snällt :)
n(Ag2CrO4) = 0.0301 / (108×2)+52+(16×4)
= 9,0 × 10^-5 mol



