Beräkning substansmängd vid jämvikt
Hej! Jag har totalt fastnat och vet inte hur jag tänker eller hur jag ska gå vidare haha... Mitt svar är fel eftersom K inte blir 0,10 om jag sätter in mitt svar för x i jämviktsekvationen: CO*H2O/CO2*H2
Jag har frågan:
För jämvikten CO(g) + H2O (g) ⇄ CO2(g) + H2(g) är jämviktskonstanten 0,10 vid 2000 K. Man blandar 0,5 mol av vardera CO, CO2, H2O och H2 i ett reaktionskärl med volymen 2,50 dm3. Blandningen upphettas till 2000 K. Hur stor substansmängd kommer att finnas av de olika ämnena när jämvikt ställt in sig?
Vad är felet i min uträkning? Eller hur ska jag försöka tänka istället?
(I frågan innan räknade man ut att Q > K, alltså reaktionen går åt vänster)
(Min lärare är sjukt seg på att svara och jag klarar inte av att vänta i flera dagar på att få tips) Tack!
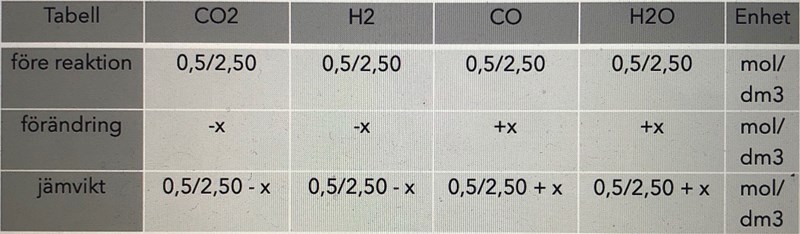

Gör dina beräkningar med substansmängder i stället för mol! I det här fallet behöver du inte ens ta med volymen, eftersom den kommer att ta ut varandra. Första raden blir alltså 0,5 0,5 0,5 0,5 och tredje raden blir 0,5-x 0,5-x 0,5+x 0,5+x.
Om du nödvändigtvis vill räkna med koncentrationer blir tredje raden (0,5-x)/2,5 (0,5-x)/2,5 (0,5+x)/2,5 (0,5+x)/2,5



