Bestäm trycket (kinetik)
Hej!
Jag håller på med denna uppgift som du kan se nedan, och är just nu på b).
En behållare med volymen 1,0 dm3 innehåller gas som har temperaturen 10 °C och trycket 200 kPa.
a) Gasens volym minskas till 0,5 dm3. Vilket blir det nya trycket?
b) Därefter höjs temperaturen till 100 °C. Vilket blir då trycket?
Jag har i både a) och b) använt mig av formeln: pV = nRT. Trycket blir då p = nRT/V. Jag vet sedan innan att R = 8,31. Nya T i uppgift b) blir då 373 K. n är okänd men mha a) uppgiften har jag kommit fram till att n = 2,406738869 genom att ställa upp formeln: n = pV/RT. Svaret på a) frågan blev 400 kPa. Så när jag skulle lösa b) frågan ställde jag upp: 400 = (2,406738869x8,31x373)/0,5 = 14 920 kPa. Detta är ju givetvis fel svar...Det jag däremot inte förstår är varför min metod är inkorrekt? Vad är det som inte går att göra som jag gör? Och varför är det fel?
När jag testade att inte omvandla temperaturen till kelvin, och multiplicerade med 100 så blev det ändå fel svar då jag fick att det blev 4000kPa...
Tack på förhand!
Temperaturen ska vara i kelvin och volymen i kubikmeter. Om du hade tagit med enheter när du räknar hade du troligtvis upptäckt det, så det är ett hett tips.
Ja, jag hade temperaturen i kelvin. Varför ska volymen vara i kubikmeter när dem i uppgiften använder kubikdecimeter?
Man kan inte anta att man ska räkna med kubikdecimeter bara för att det står i uppgiften, man måste som sagt räkna med enheterna och se vad svaret får för enhet. Det är därför de anger kubikdecimeter i frågan, för att kontrollera om du har koll på det eller inte.
Så jag har fått fel svar för att jag har använt mig av fel enheter, och inte för att jag har löst uppgiften med fel metod?
Ja, metoden fungerar.
När jag använder samma metod fast med enheter den här gången så får jag att:
400 kPa = 7460 n⋅J⋅K-1⋅mol-1⋅K / 0,5 dm3 = 14 920 (enhet?)
Vad ska då enheten bli efter 14 920?
Tryck = Kraft / Area
1 Pa = 1 N / 1 m2 = 1 N/m2
Arbete = Kraft * Sträcka
1 J = 1 N * 1 m = 1 Nm
Ersätt Pa med N/m2 och J med Nm i din formel så kan du förkorta bort en del enheter.
Oj, vi har inte gått igenom tryck och arbete i skolan ännu, det är nog därför jag har lite svårt med enheterna och inte förstår så mycket
Då kan det nog vara svårt att hänga med. Det kanske är enklare att försöka minnas att volymen är i kubikmeter i ideala gaslagen.
Teraeagle skrev:Då kan det nog vara svårt att hänga med. Det kanske är enklare att försöka minnas att volymen är i kubikmeter i ideala gaslagen.
Men när vi har hållt på med den allmänna gaslagen i skolan (vilket vi bara har gjort under en lektion för flera veckor sedan) har vi använt dm3, det är därför jag har använt det hela tiden i denna uppgift, och jag tror även det är därför dem i självaste frågan har använt dm3. Ska jag ändå alltid använda mig av m3 istället?
Det beror på vad man har för enhet på gaskonstanten R, men normalt räknar man med 8,31 J/(mol*K) och då ska volymen vara i kubikmeter.
Precis den enheten har vi också arbetat med, men då har enheten varit i kubikdecimeter.
Men hur ska jag gå vidare i #7? Går det att gå vidare utan att göra om dm3 till m3? Och går det att gå vidare utan att veta vad tryck och arbete är för något?
Nu visar jag hur man löser hela uppgiften, det blir enklast så.
En behållare med volymen 1,0 dm3 innehåller gas som har temperaturen 10 °C och trycket 200 kPa.
a) Gasens volym minskas till 0,5 dm3. Vilket blir det nya trycket?
b) Därefter höjs temperaturen till 100 °C. Vilket blir då trycket?
Uppgift a)
Metod 1: Använd Boyles lag
Metod 2: Använd ideala gaslagen och utnyttja att substansmängden inte ändras.
Nu får vi nya trycket enligt
Uppgift b)
Okej, tack! Skulle man i a) uppgiften kunna skriva 200kPa istället för 200000Pa, eller blir det fel svar då? Skulle det påverka svaret om du istället skrev 0,5 dm3 i nämnaren också?
Du måste räkna med pascal och kubikmeter.
Vad beror det på? Och hur ska jag veta när jag ska använda kPa respektive dm3 eller Pa respektive m3?
Det går inte riktigt att förklara om man inte känner till hur man ska omvandla enheter och göra en enhetsanalys. Min rekommendation är att du ber din lärare visa dig det. Om du alltid håller dig till enheterna mol, pascal, kelvin, J/(mol*K) och kubikmeter i ideala gaslagen kan du vara trygg med att svaret blir rätt.
Okej, tack för hjälpen!
Teraeagle skrev:
Nu visar jag hur man löser hela uppgiften, det blir enklast så.
En behållare med volymen 1,0 dm3 innehåller gas som har temperaturen 10 °C och trycket 200 kPa.
a) Gasens volym minskas till 0,5 dm3. Vilket blir det nya trycket?
b) Därefter höjs temperaturen till 100 °C. Vilket blir då trycket?
Uppgift a)
Metod 1: Använd Boyles lag
Metod 2: Använd ideala gaslagen och utnyttja att substansmängden inte ändras.
Nu får vi nya trycket enligt
Uppgift b)
Varför har du i uppgift a) skrivit 293K istället för 283K? Det är ju 10 grader celsius så borde det inte vara 273K + 10 = 283K?
I facit så står det även att svaret i b) uppgiften ska bli 527 kPa och inte 509 kPa som du skrev. Varför skrev du 373k istället för 383K? Det är väll 283K + 100 = 383K?
Så här gå gjorde jag istället:
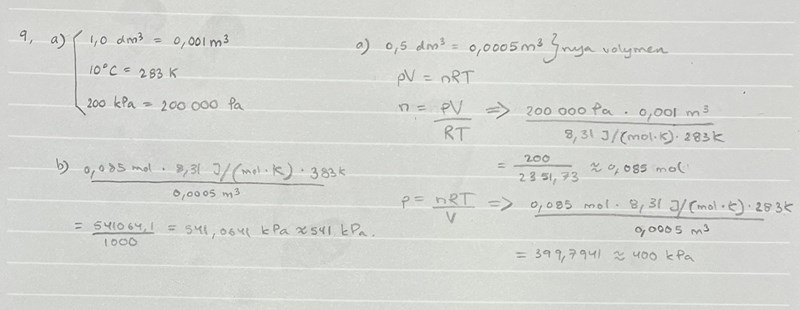 Som du ser fick jag rätt svar i a uppgiften (ungefär) men också fel i b)
Som du ser fick jag rätt svar i a uppgiften (ungefär) men också fel i b)
Helt riktigt att det ska vara 283 K och inte 293 K. Det är detta som gör att svaret blir fel även på b).
Man ska nog inte räkna på sånt här sent på kvällen :) Men bra att du upptäckte det!
Haha sånt händer ibland, men uppskattar hjälpen ändå! (:
Men i uppgift b) så skrev jag ju rätt temperatur i mitt svar, men ändå fick jag fel svar. Varför då?
Temperaturen ska vara 373 K (100 grader) i b-uppgiften. Anledningen att jag fick fel svar är för att min substansmängd från a-uppgiften blev fel.
Varför ska temperaturen vara 373 och inte 383? Det står ju att temperaturen höjs med 100°C och om temperaturen innan var 283K bord inte den nya temperaturen vara 383K?
Nej, det står att temperaturen höjs TILL 100 grader, vilket motsvarar 373 K.
Jaha, jag trodde dem menade att temperaturen då höjs med ytterligare 100°C till…Bara jag som missförstod!



