Biologilabbrapport med enzymer och reaktionshastighet
Vår klass ska ta reda på hur koncentrationen av substrat påverkar reaktionshastigheten (om mängden katalas (katalysatorn) är konstant). Denna tråd klargör nog en hel del https://www.pluggakuten.se/trad/hur-ska-man-gora-med-standardavvikelsen-nar-man-tar-medelvardet-av-ett-antal-medelvarden/. Problemet jag har nu är att jag bara har data för hur mycket O2 (en av produkterna) som har bildats efter 2 min. Ingen annan tid har jag data för (utom 0 min, men den betyder ingenting). Hur kan jag ta reda på reaktionshastigheten med bara (0, 0) och (2min, y).
Om det har bildats mer syrgas efter 2 min vet du att ökningen i substratkoncentration påverkar reaktionshastigheten. Jag skulle ha gjort en graf med antal ml syrgas på y-axeln och substratkonc. på x-axeln. Börja där och lägg gärna upp en bild på grafen när det är klart.
Teraeagle skrev :Om det har bildats mer syrgas efter 2 min vet du att ökningen i substratkoncentration påverkar reaktionshastigheten. Jag skulle ha gjort en graf med antal ml syrgas på y-axeln och substratkonc. på x-axeln. Börja där och lägg gärna upp en bild på grafen när det är klart.
Jag har redan gjort det, men det är inte en sån som vår lärare vill ha. Hon vill ha reaktionshastighet på y-axeln och koncentrationen (man hade från början) på x-axeln. Mitt problem är att det är omöjligt att göra!
Det man kan göra är att beräkna den genomsnittliga reaktionshastigheten under de 2 minuter som mätningen pågick, d.v.s.
Du kan beräkna [H2O2]slut genom att räkna om antalet ml syrgas till mol med ideala gaslagen, sedan se på reaktionsformeln för att göra ett konstaterande kring hur många mol H2O2 som då har reagerat bort.
Teraeagle skrev :Det man kan göra är att beräkna den genomsnittliga reaktionshastigheten under de 2 minuter som mätningen pågick, d.v.s.
Du kan beräkna [H2O2]slut genom att räkna om antalet ml syrgas till mol med ideala gaslagen, sedan se på reaktionsformeln för att göra ett konstaterande kring hur många mol H2O2 som då har reagerat bort.
Du menar en sekant mellan tid=0, tid=2?
Ja, precis. Det bästa är däremot att fråga läraren hur hon vill att ni ska göra. Har du någon hypotes kring hur koncentrationen påverkar reaktionshastigheten?
Teraeagle skrev :Ja, precis. Det bästa är däremot att fråga läraren hur hon vill att ni ska göra. Har du någon hypotes kring hur koncentrationen påverkar reaktionshastigheten?
Vår lärare verkar inte vilja svara på mejl, så jag kan inte fråga. Vi skulle inte ha någon hypotes, så jag har ingen. Däremot undrar jag över detta:
I boken står det: 1dm^3=0,044mol (under normala förhållanden, rumstemperatur och normaltryck)
Då måste 1ml=0,000044mol
och mol=ml/0,000044mol
Om jag gör detta i excel får jag 1miljon mol och det är helt orealistiskt. Vad har jag gjort fel?!
Du vet att 1 ml motsvarar 0,000044 mol. Alltså ska du multiplicera (och inte dividera) antalet ml med det värdet för att beräkna antalet mol. 2 ml motsvarar med andra ord 2*0,000044 mol.
Jag har en allmän fråga om standardavvikelsen och hur man räknar med den. Säg att jag har ett medelvärde a och en standardavvikelse b. Om jag då ska göra någon beräkning av a (tex multiplicera med 0,000044 för att få mol som i detta fall. Sen vidare tänkte jag multiplicera med 0,5 eftersom förhållandet mellan H2O2 och O2 är 1:2), ska jag helt enkelt göra samma beräkning med b? Tex 0,00004*b eller 0,5*b.
Japp, så länge du multiplicerar med en konstant (som i det här fallet) är det bara att multiplicera standardavvikelsen med samma värde.
Förhållandet var 2:1, jag gjorde fel. Men betyder det att 2(H2O2 kvar i lösningen):1(oxygen development)? Eller betyder det 2(mol H2O2 som har reagerat):1(oxygen development)?
Formeln är
Varje mol O2 har alltså bildats från ett dubbelt så stort antal H2O2. Siffran du räknar ut är den mängd som har reagerat.
Jag har fasnat på hur jag ska få fram koncentrationen av H2O2 (efter 20min). Jag vet att det är
eftersom 5ml=3ml H2O2 lösning+2ml jästlösning
"Mol" i detta fall är
Men vad är ? Koncentrationerna som vi använde för vardera provrör mätte vi i procent och inte mol/volym, så jag vet inte. Procent partiklar eller procent massa?
För att räkna ut reaktionshastigheten behöver du inte veta hur mycket H2O2 som fanns från början. Räkna ut hur många mol syre som har bildats. Omvandla det till ett antal mol H2O2. Dela med lösningens volym (här får man då anta att den är konstant), d.v.s. inklusive jästlösningen. Dela sedan med 2 min. Du får då den genomsnittliga reaktionshastigheten uttryckt som mol/(ml*min).
Edit: Ser nu att det kanske inte riktigt framgick i mitt tidigare inlägg.
Teraeagle skrev :Omvandla det till ett antal mol H2O2.
Antal mol H2O2 som...? ...har reagerat? ...är kvar?
Precis. Om du har 1 mol O2 betyder det att 2 mol H2O2 har reagerat. Dela då 2 mol med totala lösningens volym och sen med tiden för att få reaktionshastigheten.
Nu har jag gjort det och dubbelcheckat, är runt 10^-6 mol/s rimligt?
Jag har också fått ett högre värde på reaktionshastigheten hos test1 där vi hade mindre katalas... Det måste vara fel. Det måste ha gjort med att jag delade på 5 respektive 9 eftersom det fanns olika mycket ml lösning i provrören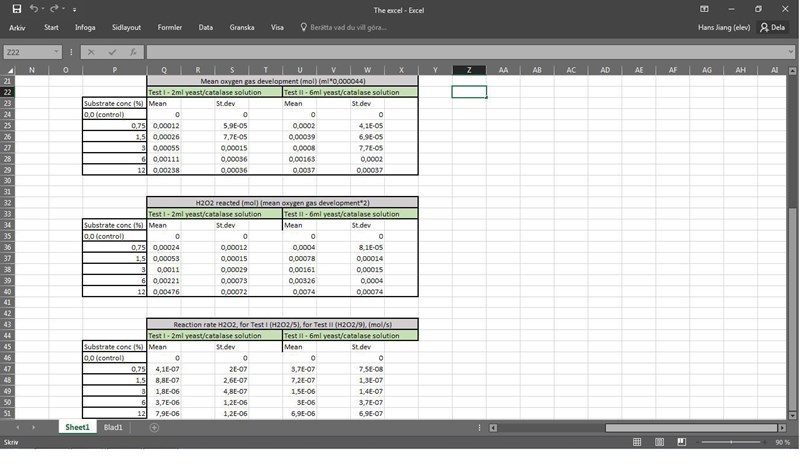
Jag räknade ut hastigheten för den första labbgruppen med substratkoncentrationen 6 %. Då började jag med att beräkna medelvärdet för de fem grupperna och fick det till 25,1428 ml O2. Det motsvarar 25,1428*0,000044 mol O2. Då har mängden H2O2 minskat med dubbelt så mycket, d.v.s. 2*25,1428*0,000044 mol. Dela sedan med volymen (2 ml) och tiden (2 min) så får du värdet
Sedan gäller det att göra på motsvarande sätt för de andra substratkoncentrationerna.
Edit: Det kan vara lämpligare att omvandla ml till kubikdecimeter för att få ett mer lätthanterligt värde. Då multiplicerar du det förra värdet med 1000:
Välj själv det som du tycker verkar bäst.
Teraeagle skrev :Jag räknade ut hastigheten för den första labbgruppen med substratkoncentrationen 6 %. Då började jag med att beräkna medelvärdet för de fem grupperna och fick det till 25,1428 ml O2. Det motsvarar 25,1428*0,000044 mol O2. Då har mängden H2O2 minskat med dubbelt så mycket, d.v.s. 2*25,1428*0,000044 mol. Dela sedan med volymen (2 ml) och tiden (2 min) så får du värdet
Sedan gäller det att göra på motsvarande sätt för de andra substratkoncentrationerna.
Edit: Det kan vara lämpligare att omvandla ml till kubikdecimeter för att få ett mer lätthanterligt värde. Då multiplicerar du det förra värdet med 1000:
Välj själv det som du tycker verkar bäst.
Varför 2ml för att jästlösningen var 2ml? Jästlösningen blandades med 3ml H2O2 lösning också, ska inte den räknas med så att volymen (för hela provröret) blir 5ml?
När jag delar mol(H2O2) från TestII med volymen, ska jag dela med en volym som är större än för Test I? Det verkar orättvist, för jag vet att reaktionshastigheten kommer vara högre för experimentet med mer jäst (Test II), men om jag också delar med ett större tal så kanske den skillnaden jämnas ut?
Japp, du ska såklart använda 5 ml och inte 2 ml!
Reaktionshastigheten beror oftast på koncentrationen hos reaktanten/reaktanterna. Då måste man ta hänsyn till både antalet mol och volymen. Testa att räkna ut värdena så kan vi försöka analysera dem sen.
Jag har redan gjort det, och min uträkning är som din, med enda skillnaden att jag delade med 120s istället för 2min. Jag får lägre reaktionshastigheter i Test II! Jag misstänker starkt att det var för att jag delade med 5ml på Test I och 9ml på Test II, vilket inte borde vara fel.
Nej, det är nog ingenting som är fel.
"Vår klass ska ta reda på hur koncentrationen av substrat påverkar reaktionshastigheten (om mängden katalas (katalysatorn) är konstant)"
Egentligen är det mest intressant att se hur reaktionshastigheten då varierar vid de olika koncentrationerna för 2 ml och sedan göra samma jämförelse vid 6 ml. Mitt tips är att du gör två grafer: procent H2O2 på x-axeln och reaktionshastigheten på y-axeln (en för 2 ml och en för 6 ml). Jämför sedan utseendet på kurvorna.
Teraeagle skrev :Nej, det är nog ingenting som är fel.
"Vår klass ska ta reda på hur koncentrationen av substrat påverkar reaktionshastigheten (om mängden katalas (katalysatorn) är konstant)"
Egentligen är det mest intressant att se hur reaktionshastigheten då varierar vid de olika koncentrationerna för 2 ml och sedan göra samma jämförelse vid 6 ml. Mitt tips är att du gör två grafer: procent H2O2 på x-axeln och reaktionshastigheten på y-axeln (en för 2 ml och en för 6 ml). Jämför sedan utseendet på kurvorna.
Joho, det måste ju vara något fel om experimentet med mer katalas hade lägre reaktionshastighet! Om inte vattnet i jästblandningen bidrog till att sänka reaktionshastigheten mer än vad själva jästen bidrog till att höja den... Men så kan det inte ha varit, det känns inte som det.
Jag tror inte att jag behöver stoppa in den i en graf, jag ser att den är linjär och det är inte det min lärare vill ha... Är det något mer som kan göras utifrån informationen som jag har samlat?
Om inte vattnet i jästblandningen bidrog till att sänka reaktionshastigheten mer än vad själva jästen bidrog till att höja den
Här är du något på spåren. Reaktionshastigheten beror både på koncentration och katalysator. Lägg ändå in det i en graf eller visa vilka värden du fick. Är den linjär i båda fallen?
Teraeagle skrev :Om inte vattnet i jästblandningen bidrog till att sänka reaktionshastigheten mer än vad själva jästen bidrog till att höja den
Här är du något på spåren. Reaktionshastigheten beror både på koncentration och katalysator. Lägg ändå in det i en graf eller visa vilka värden du fick. Är den linjär i båda fallen?
Den ser faktiskt inte lika linjär ut som jag tänkte mig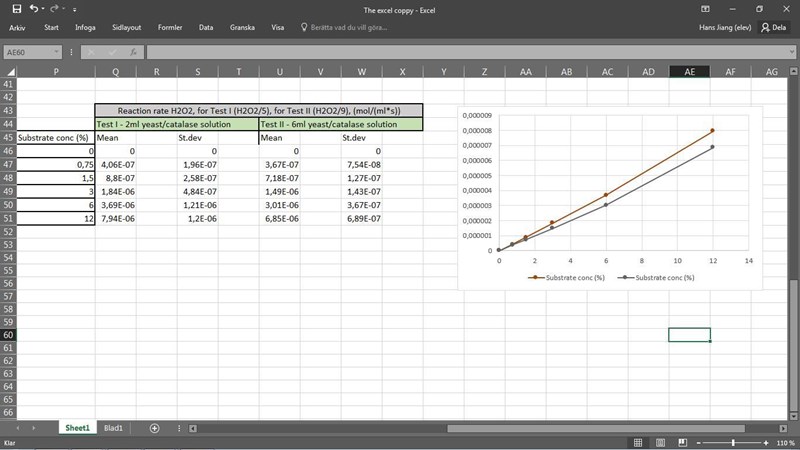
Däremot vill vår lärare se en sån här
Jag vet att det är mycket ovetenskapligt att försöka anpassa labbresultat efter nåt ideal istället för att ta det som det är, men nu måste jag.
(Jag gillar den nya infoga-funktionen! Jag tror att den fanns förut men den använde jag inte för jag visste inte hur)
Så här ser min graf ut för 2 ml jästlösning, så det är någonting som du gör fel. Har du möjligtvis tagit med alla nollor när du har räknat ut medelvärdena?
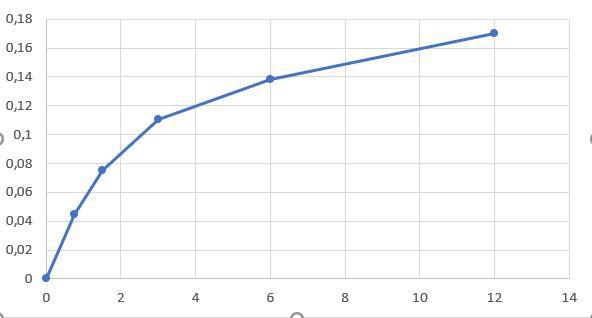
Teraeagle skrev :Så här ser min graf ut för 2 ml jästlösning, så det är någonting som du gör fel. Har du möjligtvis tagit med alla nollor när du har räknat ut medelvärdena?
Vilka nollor? Värdena från labbgrupp 1 labbpar 1? Nej de tog jag inte med...
Hur kan du få så stora tal? De är ju runt 10^-1 och 10^-2
Värdena har enheten och därför blir de rätt stora.
Steg för steg:
- Beräkna medelvärdena för varje substratkonc. Exkludera alla nollor och N/A.
- Multiplicera varje värde med 0,000044 för att få det till mol O2
- Multiplicera sedan med 2 för att få det till mol reagerad H2O2
- Dividera med tiden (jag tog minuter).
- Dividera med lösningens totalvolym, d.v.s. jästlösning+substrat (jag tog dm3) för att bestämma reaktionshastigheten.
- Rita en graf med substratkonc. på x-axeln och reaktionshastigheten på y-axeln.
Teraeagle skrev :Värdena har enheten och därför blir de rätt stora.
Steg för steg:
- Beräkna medelvärdena för varje substratkonc. Exkludera alla nollor och N/A.
- Multiplicera varje värde med 0,000044 för att få det till mol O2
- Multiplicera sedan med 2 för att få det till mol reagerad H2O2
- Dividera med tiden (jag tog minuter).
- Dividera med lösningens totalvolym, d.v.s. jästlösning+substrat (jag tog ml) för att bestämma reaktionshastigheten.
- Rita en graf med substratkonc. på x-axeln och reaktionshastigheten på y-axeln.
Jag omvandlade inte till dm^3 i nämnaren.
1. Jag exkluderade inte N/A eftersom att det verkade som att excel var smart nog att räkna N/A som ingen data.
Resten har jag precis gjort som din lista...
EDIT: Jag har checkat, excel räknar alla celler med namn (och inte värden) som "ingen data". Så det ska inte bli något fel för att jag inte har exkluderat "N/A"
Har du samma värden för antalet ml O2 vid 2 ml jästlösning?
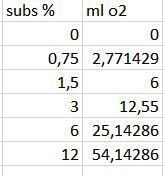
Teraeagle skrev :Har du samma värden för antalet ml O2 vid 2 ml jästlösning?
Ja
Även för antalet mol av O2 och reagerad H2O2?
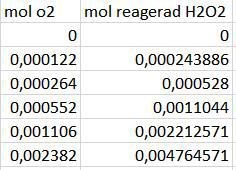
Teraeagle skrev :Även för antalet mol av O2 och reagerad H2O2?
Ja
Senhar du delat 0,000243886 med (2+0,75) ml och sen igen med 60 sekunder? I så fall får du reaktionshastigheten i enheten mol/(ml*sek), vilket väl var det du använde?
Teraeagle skrev :Senhar du delat 0,000243886 med (2+0,75) ml och sen igen med 60 sekunder? I så fall får du reaktionshastigheten i enheten mol/(ml*sek), vilket väl var det du använde?
Nej, jag dividerade med 2+3=5ml, sen dividerade jag med 120sekunder, 5*120 på alla i Test I alltså.
Jag delade inte med
120*(2+0)
120*(2+0,75)
120*(2+1,5)
120*(2+3)
120*(2+6)
120*(2+12)
Nej, nu börjar det bli sent. Menade såklart 120 och inte 60 sekunder. Var volymen 5 ml i samtliga fall? Hur har du koll på substratkonc.? Hade ni en lösning med H2O2 som sedan späddes ut varefter ni tog 5 ml?
Teraeagle skrev :Nej, nu börjar det bli sent. Menade såklart 120 och inte 60 sekunder. Var volymen 5 ml i samtliga fall? Hur har du koll på substratkonc.? Hade ni en lösning med H2O2 som sedan späddes ut varefter ni tog 5 ml?
Volymen var 5ml i samtliga fall ja, 3ml H2O2 av olika koncentrationer+2ml jästlösning
Vi förberedde 6 bägare med alla koncentrationerna, sen tog vi 3ml av vardera bägare till 6 provrör. Sen 2ml jästlösning i varje provrör.
Jag kan faktiskt inte svara på varför kurvan ser ut att stämma när man gör med min metod, eftersom jag då satte konc. H2O2 som volymen (blandade ihop dem). Om jag istället räknar med volymen 5 ml får jag samma kurva som du. Den enda förklaringen jag kan se är att det har skett någon ihopblandning av enheter eller liknande. Skulle du kunna ladda upp en bild eller skriva av texten från labbhandledningen? Det kan vara lättare att upptäcka eventuella misstag då.
Hej, jag går i samma klass som Qetsiyah, här är instruktionerna, det är på engelska dock men men...
Väkommen till Pluggakuten, marremarre.
Jag lyckas fortfarande inte hitta något fel bland beräkningarna, men efter att ha sett instruktionen tror jag nog att det räcker med att presentera reaktionshastigheten som volym producerad syrgas per tidsenhet (d.v.s. ml/min eller liknande). När jag tog dina framräknade värden och lade till standardavvikelserna så ser man att den är rätt hög på punkten längst till höger:
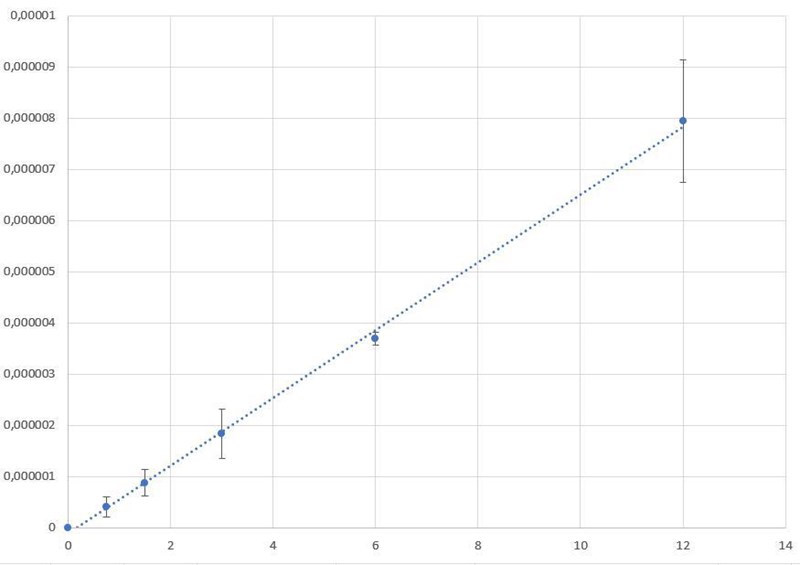
Det som visas är medelvärdet +/- en standardavvikelse. Om värdet längst till höger egentligen ligger lite längre ner så får man en kurva som ser ut mer som den förväntade. Det behöver alltså inte vara något fel, bara det att man lurar sig själv genom att titta på medelvärdena. Har du testat att göra motsvarande graf för ett och samma försök, d.v.s. utan att beräkna några medelvärden? Om inte, testa med det.
Okej, vi ska prova det! Tack så mycket
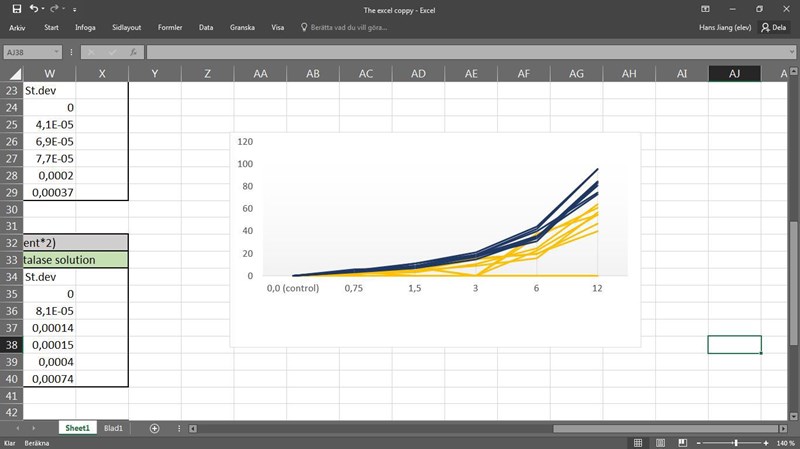
Såhär kanske? Ml syrgas på y-axeln och H2O2 koncentration på x-axeln. Blåa kurvor är Test II och gula är Test I.
Om du ska ha ett mått hastigheten så måste du dela värdena på y-axeln med tiden (2 min).
I övrigt kan man se att ökad koncentration av H2O2 leder till ökad reaktionshastighet, vilket är att vänta. Anledningen till att kurvan borde plana ut efter en viss koncentration är att det då inte finns tillräckligt med enzym för att katalysera reaktionen ännu snabbare. ”Flaskhalsen” blir alltså till slut hur många lediga enzymmolekyler som finns per minut. Det kan vara så att koncentrationen av H2O2 inte var tillräckligt hög för att nå dit (om man googlar på den här uppgiften så används oftast högre H2O2-koncentrationer).
Teraeagle skrev :I övrigt kan man se att ökad koncentration av H2O2 leder till ökad reaktionshastighet, vilket är att vänta. Anledningen till att kurvan borde plana ut efter en viss koncentration är att det då inte finns tillräckligt med enzym för att katalysera reaktionen ännu snabbare. ”Flaskhalsen” blir alltså till slut hur många lediga enzymmolekyler som finns per minut. Det kan vara så att koncentrationen av H2O2 inte var tillräckligt hög för att nå dit (om man googlar på den här uppgiften så används oftast högre H2O2-koncentrationer).
Jomen precis, det var ju också det som vår lärare "råkade" berätta om lektionen innan vi gjorde labben. Jag antar ju att hon vill att jag ska skriva om hur jag helt oberoende av det hon hade sagt på lektionen "upptäckte" "flaskhals" fenomenet, men jag kan ju inte det. Jag antar att du menar att jag inte kan det. Vad ska jag då göra?
EDIT: Vet du förresten hur jag ska dela alla värden med två nu?
Nja, du kan ju bara skriva om resultatet du fick och inte det du ”borde ha fått”. Du kan åtminstone dra en slutsats kring
- Hur reaktionshastigheten beror på komcentrationen av H2O2 (för de koncentrationer som testades).
- Hur mängden jäst/katalas påverkar reaktionshastigheten.
Angående beräkningarna så har du gjort rätt, men det kan vara överkurs att räkna ut hastigheten som mol/(ml*min) då det räcker att beskriva den som ml O2/min för att dra samma slutsatser.
Teraeagle skrev :Jag kan faktiskt inte svara på varför kurvan ser ut att stämma när man gör med min metod, eftersom jag då satte konc. H2O2 som volymen (blandade ihop dem). Om jag istället räknar med volymen 5 ml får jag samma kurva som du.
Jag har sett på en av mina klasskamraters exceldokument, och han delade inte med 5ml (alltså H2O2 lösningens volym+jästlösningens volym), utan han delade med volymen av bara H2O2 alltså 3ml*koncentrationen, alltså 0,75 och 1,5 och 3 och 6 och 12. Han får en sån graf som du fick och som är förväntat och som vår lärare vill ha, så tror du att det är en rimlig metod?
Jag tolkade procentsatserna som viktprocent (om det inte är preciserat vikt-% eller volym-% brukar man anta vikt-%).
Det är viktigare att välja axlar så att grafen blir logisk. I det där fallet blir enheten på y-axeln mol/(vol H2O2 * min) och jag vet inte riktigt hur man skulle motivera det valet. Det är inte fel, men man bör motivera det bättre än att "det är så läraren vill att det ska se ut". Välj den graf som du tycker är enklast att förklara och som är lättast för läsaren att tolka.
Teraeagle skrev :Om inte vattnet i jästblandningen bidrog till att sänka reaktionshastigheten mer än vad själva jästen bidrog till att höja den
Här är du något på spåren. Reaktionshastigheten beror både på koncentration och katalysator. Lägg ändå in det i en graf eller visa vilka värden du fick. Är den linjär i båda fallen?
Angående detta, kan jag verkligen dela med 0,005dm^3 och 0,009dm^3? Jag kanske ska dela med 2ml vilket var volymen av H2O2-lösning, för annars får jag inte det förväntade resultatet att Test II (med mer jästlösning) hade högre reaktionshastighet... Jag tycker att det är konstigt att jag ska få en helt olik slutsats jämfört med andra i min klass bara för att jag mäter reaktionshastighet i mol/(dm^3*min) och de i syrgas (ml). Test II producerade ju mer syrgas i ml än Test I (på två minuter)
Teraeagle skrev :Angående beräkningarna så har du gjort rätt, men det kan vara överkurs att räkna ut hastigheten som mol/(ml*min) då det räcker att beskriva den som ml O2/min för att dra samma slutsatser.
[...]
Det är viktigare att välja axlar så att grafen blir logisk. I det där fallet blir enheten på y-axeln mol/(vol H2O2 * min) och jag vet inte riktigt hur man skulle motivera det valet. Det är inte fel, men man bör motivera det bättre än att "det är så läraren vill att det ska se ut". Välj den graf som du tycker är enklast att förklara och som är lättast för läsaren att tolka.
Teraeagle skrev :Teraeagle skrev :Angående beräkningarna så har du gjort rätt, men det kan vara överkurs att räkna ut hastigheten som mol/(ml*min) då det räcker att beskriva den som ml O2/min för att dra samma slutsatser.
[...]
Det är viktigare att välja axlar så att grafen blir logisk. I det där fallet blir enheten på y-axeln mol/(vol H2O2 * min) och jag vet inte riktigt hur man skulle motivera det valet. Det är inte fel, men man bör motivera det bättre än att "det är så läraren vill att det ska se ut". Välj den graf som du tycker är enklast att förklara och som är lättast för läsaren att tolka.
Ja, men de i min klass som mäter reaktionshastigheten i ml O2/min får ju att Test II har en snabbare reaktionshastighet än Test I... Vi kan inte dra samma slutsatser och det är det som är problem.
Ja, det är därför det är så kul med laborationer. Man får alltid olika resultat och det går inte att säga att det ena resultatet är fel och det andra är rätt :)
Om du vill ha ett argument för din metod, så kan du hävda att IUPAC (som bestämmer riktlinjerna för allting inom kemi) rekommenderar att man uttrycker reaktionshastigheten som du har gjort. Det andra sättet med ml O2/min kallas för "rate of conversion" på engelska (jag antar att "omsättningshastighet" fungerar på svenska, men då blir nog några ekonomer arga). Se t.ex. den här länken:
https://goldbook.iupac.org/html/R/R05156.html
Det bästa alternativet är såklart att fråga din lärare vilka enheter som ska vara på axlarna. På så sätt slipper du missförstånd.
Teraeagle skrev :Ja, det är därför det är så kul med laborationer. Man får alltid olika resultat och det går inte att säga att det ena resultatet är fel och det andra är rätt :)
Om du vill ha ett argument för din metod, så kan du hävda att IUPAC (som bestämmer riktlinjerna för allting inom kemi) rekommenderar att man uttrycker reaktionshastigheten som du har gjort. Det andra sättet med ml O2/min kallas för "rate of conversion" på engelska (jag antar att "omsättningshastighet" fungerar på svenska, men då blir nog några ekonomer arga). Se t.ex. den här länken:
https://goldbook.iupac.org/html/R/R05156.html
Det bästa alternativet är såklart att fråga din lärare vilka enheter som ska vara på axlarna. På så sätt slipper du missförstånd.
Jag vet nu varför jag drog fel slutsats, om man räknar in den totala volymen av jäst lösning/H2O2 lösning när man anger H2O2 concentration i procent blir det ju såklart inte som det ursprungliga 0,75 1,5 3 6 och 12. Om man räknar in volymen som ökade när vi la till jästlösningen så får man att Test II har högre reaktionshastighet.
Problemet är att jag har skrivit en hel del (typ allt) om hur vattnet i jästlösningen bidrog mer till att sänka reaktionshasigheten än jästen bidrog till att höja den osv... Vad ska jag göra nu? Tycker du fortfarande att min metod kan vara rätt? Varför?
Om du vet att du har räknat fel så är det ju såklart fel. Däremot är det fortfarande så att man kan få en högre reaktionshastighet som mol/(ml*min) i det ena fallet men en högre ml O2/min i det andra fallet.
Teraeagle skrev :Om du vet att du har räknat fel så är det ju såklart fel. Däremot är det fortfarande så att man kan få en högre reaktionshastighet som mol/(ml*min) i det ena fallet men en högre ml O2/min i det andra fallet.
Men då backar jag och säger att jag tror att jag har fel. Jag vill veta om du tror att jag har fel utifrån det jag sa om att % H2O2 faktiskt ändras när man lägger till jästlösning.
Ja, du späder ju ut H2O2-lösningen vid tillsats av jästlösningen. Det måste du ta hänsyn till när du väljer x-värden till grafen och ifall du väljer att presentera y-värdena som mol/(ml*min).
Jag har skrivit på jättemånga ställen "yeast/H2O2 solution", i vanlig svenska/engelska betyder det ju "eller", men jag menar ju såklart "och". Kan jag behålla det? Är "reacting solution" bättre att säga"?
Ja, eller kanske ”total solution”.
Nu har vi lämnat in biologilabben! Jag hoppas att det går bra.
Tack så jättejätte mycket för all hjälp!
Det blev lite hit och dit från min sida. Svårt att ge bra svar när man inte har gjort labben själv eller kan sitta och bearbeta resultaten. Hoppas att rapporten blev bra!



