Ch2Cl2 bara van Der waals?
Min fråga är bildar bara dimetylklorid van der waals eller bildar den andra typer av bindningar. Jag tänker enbart walls eftersom den är symmetriskt borde inte dipol dipol kunna bildas och utan N,O och F kan i nga vätebindingar. Tänker jag rätt?
Det finns inget ämne som heter dimetylklorid, däremot diklormetan som jag antar är det du menar. Den molekylen är inte symmetrisk och det finns en hyfsad skillnad i elektronegativitet mellan klor och kol, vilekt talar för att ämnet bildar dipol-dipolbindningar. Kokpunkten talar också för det eftersom den är ganska hög, 40 grader.
Teraeagle skrev:Det finns inget ämne som heter dimetylklorid, däremot diklormetan som jag antar är det du menar. Den molekylen är inte symmetrisk och det finns en hyfsad skillnad i elektronegativitet mellan klor och kol, vilekt talar för att ämnet bildar dipol-dipolbindningar. Kokpunkten talar också för det eftersom den är ganska hög, 40 grader.
Exakt, oj Måste öva lite IUPAC, men varför är den inte symetstrisk drar jag en linje rakt igenom den så är den väl lika på båda sidorna?
Nej, molekylen är inte symmetrisk. Bägge kloratomerna sitter på ena sidan av molekylen.
har det med kommer inte ihåg namnet på metoden, men när man ritar saker "nord och syd" så sticker de in i pappret därav är de på samma sida? eller det kan ju inte heller stämma CO2 binder ju och den är ju symetrisk trots att den har 120graders bindningar. Fattar inte riktgit hur den inte är symetriskt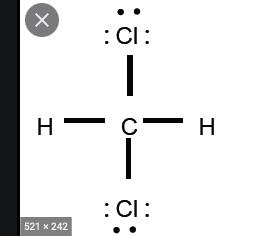
Nu är den ritad i 2D. Alla molekyler är ju egentligen tredimensionella, så 2D-strukturen stämmer inte helt överens med verkligheten. Har du någon idé om hur molekylen kan se ut i 3D?




