Dipoler
Uppgiften var: Rita en valfri molekyl som har summaformeln C4H8O2. Din ritade molekyl ska vara en dipol. Sätt ut δ+ och δ– på rätt ställe i din dipol.
Jag ritade dipolen som man kan se i bilden, men jag vet inte vart jag ska sätta ut δ+ och δ–.

Vilket grundämne har högst elektronegativitet - C, O, H?
Det ska ha δ–.
MaKe skrev:Vilket grundämne har högst elektronegativitet - C, O, H?
Det ska ha δ–.
Det är syre, men vart ska den sitta, det är ju två syre?
GoskJW skrev:MaKe skrev:Vilket grundämne har högst elektronegativitet - C, O, H?
Det ska ha δ–.
Det är syre, men vart ska den sitta, det är ju två syre?
På båda syreatomerna
MaKe skrev:GoskJW skrev:MaKe skrev:Vilket grundämne har högst elektronegativitet - C, O, H?
Det ska ha δ–.
Det är syre, men vart ska den sitta, det är ju två syre?
På båda syreatomerna
Okej men vart ska δ+ vara? På H för den har lägst elektronegativitet?
GoskJW skrev:MaKe skrev:GoskJW skrev:MaKe skrev:Vilket grundämne har högst elektronegativitet - C, O, H?
Det ska ha δ–.
Det är syre, men vart ska den sitta, det är ju två syre?
På båda syreatomerna
Okej men vart ska δ+ vara? På H för den har lägst elektronegativitet?
δ+ både på H och C (kolatomen som syreatomerna är kopplade till)
Jag fattar inte riktigt ska det vara δ+ på alla h och alla C`?
Karbonyl- och hydroxylgruppen drar till sig elektrondensitet eftersom syre är mer elektronegativt än kol. Det kommer alltså finnas en "dragningskraft" i riktning syregrupperna. Jag tänker så här:
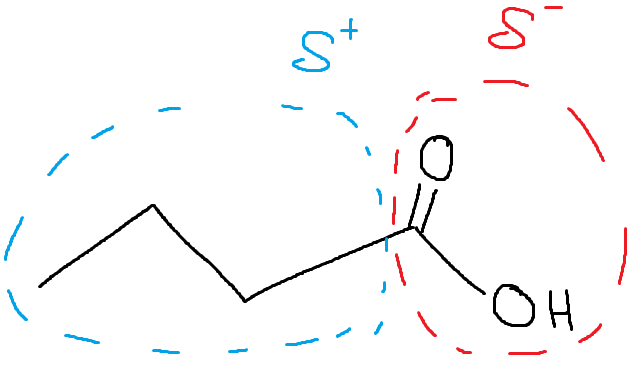
Jag tänker mer så här:
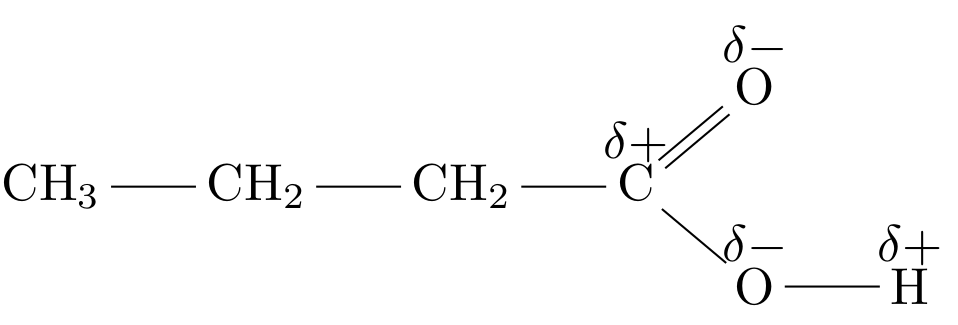
I kemi nivå 1 tar man inte upp hur resten av kolatomerna och väteatomerna påverkas.



