Ekvivalens och "överskott"?
Hej!
Är det inte rätt att mol-förhållandet är 1:1 mellan S och Cu2S? Borde man inte då kunna anta att substansmängden är detsamma? Jag fick endast rätt svar när jag använde mig av 2:1 förhållandet mellan 2Cu och Cu2S. I facit stod det bara "n(Cu) / n(S) - Svavel överskott" Förstår inte vad det betyder? Hur vet vi att det är överskott? Varför kan vi inte använda oss av dess substansmängd när det är överskott?n :/ Förlåt för många frågor i ett men är förvirrad..
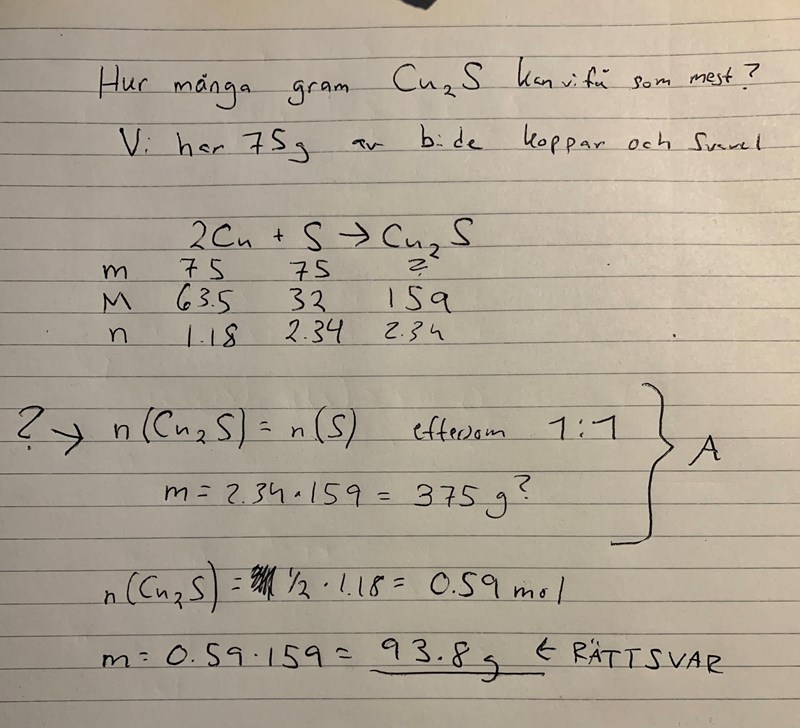
Kom ihåg att du har olika mängder av kopparatomer och svavelatomer i 1 molekyl Cu2S.
1 koppar atom väger heller inte lika mycket som 1 svavel atom.
Tänk såhär:
75 gram koppar är 75/63,546 = 1.18 mol koppar
(63,546 är atommassan hos koppar).
75 gram svavel är 75/32.065 = 2.34 mol svavel.
(32.065 är atommassan hos svavel).
Nu kan vi titta på Cu2S, för varje styck av detta ämne krävs 2 koppar atomer och 1 svavel atom. Här får du ta reda på vilken som är den "begränsande" delen, dvs det ämne det finns för lite av.
Utgå från att du har oändligt med svavel och 1.18 mol koppar, hur många mol Cu2S kan du då få? Jo, 1.18/2 = 0.59 mol, för det krävs 2 koppar atomer för varje styck Cu2S.
Nu utgår du från att det finns oändligt med koppar och 2.34 mol svavel, hur många mol Cu2S kan du få då? Jo, 2.34/1 = 2.34 mol, för det endast krävs 1 svavel atom för varje styck Cu2S.
Här får du då reda på att det finns en överskott av svavel mot koppar och koppar är den begränsande faktorn, så då utgår du från hur många mol Cu2S som kan bildas med 1.18 koppar och oändligt med svavel vilket är 0.59 mol. 0.59 * 159 = 93.8 g. 159 kommer då från atommassan av Cu2S.
Om du har några frågor, ställ dem gärna :d


