Elektron konfiguration
Hej, jag hade lite svårt o förstå varför M-skalet behåller ibland bara 8 elektroner när den har plats till 18, eftersom jag hittade inte direkt en bra förklarare. Nu förstår jag att orsaken är att valenselektronerna i yttersta skäl bör inte överskrida 8. Men jag råkade nu för en fråga där jag bör hitta laddningen för några ämnen när de blir joner. Jag fastnade hos ämnet Barium, Ba, den har 56 elektroner, jag fördelade de från k-skalet till O-skalet på detta vis, 2,8,18,20,8. Men såg sen att det var fel och att de delade det såhär istället, 2,8,18,18,8,2. Varför har de lagt 18 elektroner i N-skalet när man kan lägga 20 o få 8 i valenselektronerna?
Skalen K, L, M, N, ... är i sig uppdelade i underskal. För grundämnena med små atomtal kan man bortse från detta men det börjar spela in när man har större atomtal då elektronskalen senare i sekvensen har fler underskal och
K : 2 (1 underskal)
L : 2 + 6 = 8 (2 underskal)
M: 2 + 6 + 10 = 18 (3 underskal)
N : 2 + 6 + 10 + 14 = 32 (4 underskal)
Dessa underskal brukar hänvisas till som s(2), p(6), d(10), f(14), g(18), ... och elektronskalen fylls inte upp till fullo innan övre utan första underskalet i ett övre skal kan fyllas upp innnan det första underskalet i ett nedre skal är fullt.
Egentligen kan man inte förutsäga var elektronerna hamnar utifrån enkla numeriska regler utan de är lite mer komplicerade.
Elektronskal nr har platsför stycken elektroner.
De olika skalen är indelade i olika "underskal" som kallas orbitaler (utom det innersta skalet, där det bara får plats 2 elektroner). De olika underskalen kallas orbitaler, och i de olika orbitalerna inom varje skal får det plats 2, 6, 10 respektive 14 elektroner (ännu krångligare orbitaler behöver man inte bry sig om i kemi). De olika orbitalerna i samma skal har lite olika energi. Orbitalerna betecknas s, p, d och f (det kommer egentligen från olika elektronövergångar, som fick sina namn innan man hade kommit på att det existerar orbitaler).
I det periodiska systemet fyller man på med elektroner "inifrån" när man "skapar" större och större atomer. Man fyller hela tiden på i den orbital som har lägst energi.
Första elektronern hamnar i 1s (H) och nästa också i 1s (He). Första skalet är fullt. H
Nästa 2 elektroner hamnar i 2s (Li och Be) och de 6 därefter i 2p (B, C, N, O, F, Ne), och skal 2 är fullt.
Därefter hamnar 2 elektroner i 3s och 6 i 3p, och vid det laget är vi framme vid argon, men sedan är det så att orbitalen 4s har lägre energi än 3d, så de två nästa elektronerna hamnar där (K och Ca) innan man fyller på i 3d. Atomerna som motsvarar 3d är alla metaller och de kallas övergångsmetaller. När 3d är fyllt fylls 4p, och när dessa orbitaler är fulla (Kr) så upprepas samma procedur med orbitalerna 5s, 4d och 5p, och när man är framme vid xenon blir det likadant fast värre - nu är det inte bara 6s som krånglar till det, utan även 4f. Det är de atomer som "bildas" genom att man fyller på i 4f som finns i det undre bandet av atomer som brukar finnas strax under själva periodiska systemet (de på den nedersta raden är de som fylls på i 5f).
Tänk på att man inte har hittat på en så här krånglig modell bara för att göra det besvärligt för den som studerar kemi, utan för att det (faktiskt) är den enklaste modell man har kunnat komma på, som förklarar varför atomen med si-och-så många protoner i sin kärna och därmed lika många elektroner har de egenskaper som man har konstaterat att de har. Alla ädelgaser har t ex fyllda p-orbitaler ytterst (utom stackars helium, som är för liten för att ha några p-orbitaler) och alla alkalimetaller har en enda elektron utanför ett ädelgasskal.
Det kan tilläggas att en bra kom-ihåg-regel är Aufbau-principen och madelungs regel för hur skal och orbitaler populeras:
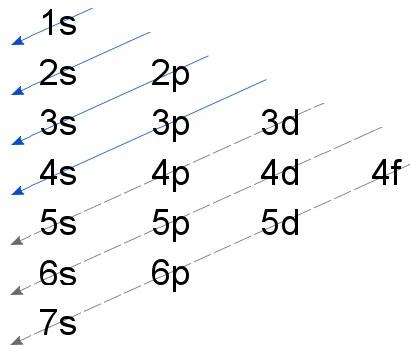
För Barium har vi 56 elektroner. Det ger följande konfiguration:
Om vi delar upp och snyggar till får vi:
Alltså får vi i skalformuleringen att vi har:
2, 8, 18, 18, 8, 2
Tack så mycket för hjälpen..





