Elektronerna hos OH
Hydroxigruppen har väl laddningen -1, vilket då innebär att syret har 7 valenselektroner. Hur fungerar detta då till exempel hos alkoholer? Om OH ska ha laddningen -1 så måste ju syret ta med sig en valenselektron från bindningen mellan C och O? Då blir det ju ingen bindning kvar där.
Kol har ju 4 valenselektroner. Är det en av dessa elektroner som OH tar med sig för att få laddningen -1? Så när den från början reagerar med C så har den ej laddningen -1? För annars förstår jag inte hur det går ihop, om syret redan har 8 (eller 7, men med bindningen till H) elektroner när den kommer till kol. Då skulle den ju ej binda in?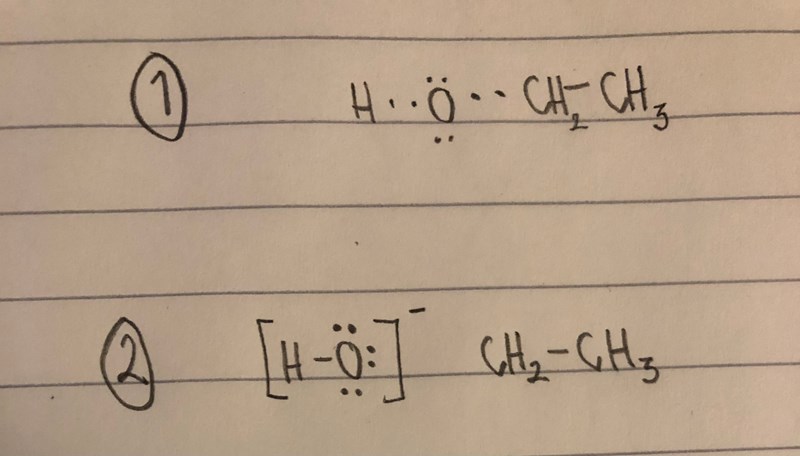
sund20 skrev:Hydroxigruppen har väl laddningen -1, vilket då innebär att syret har 7 valenselektroner. Hur fungerar detta då till exempel hos alkoholer? Om OH ska ha laddningen -1 så måste ju syret ta med sig en valenselektron från bindningen mellan C och O? Då blir det ju ingen bindning kvar där.
Kol har ju 4 valenselektroner. Är det en av dessa elektroner som OH tar med sig för att få laddningen -1? Så när den från början reagerar med C så har den ej laddningen -1? För annars förstår jag inte hur det går ihop, om syret redan har 8 (eller 7, men med bindningen till H) elektroner när den kommer till kol. Då skulle den ju ej binda in?
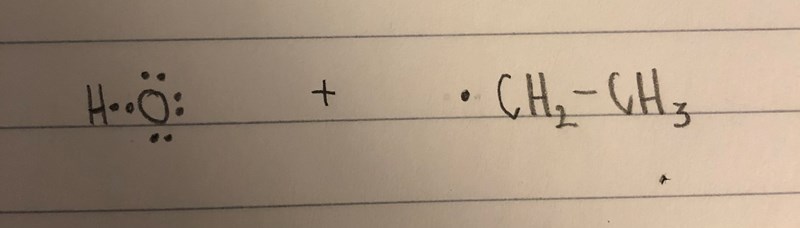 Hur kan det uppstå en bindning här? Om OH har åtta elektroner, då har den ju ingen elektron att bilda par med den ensamma elektronen hos C?
Hur kan det uppstå en bindning här? Om OH har åtta elektroner, då har den ju ingen elektron att bilda par med den ensamma elektronen hos C?
Varför skulle syret ha 7 valenselektroner, menar du?
Smaragdalena skrev:Varför skulle syret ha 7 valenselektroner, menar du?
Alltså syre har väl 6 valenselektroner vanligtvis, men OH har väl 8 valenselektroner totalt? Det är denna bilden jag tänker på: 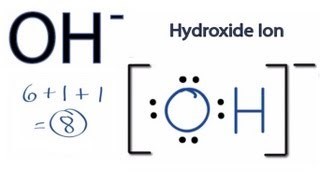
Eller ja syret har ju 6 valenselektroner, men den har ju en extra elektron som gör att det blir -1? En elektron kommer ju från H. Då tänker jag att de andra 7 borde komma från syre. O har ju sitt skal med 8 valenselektroner. Hur kan då reaktion ske?
sund20 skrev:Smaragdalena skrev:Varför skulle syret ha 7 valenselektroner, menar du?
Alltså syre har väl 6 valenselektroner vanligtvis, men OH har väl 8 valenselektroner totalt? Det är denna bilden jag tänker på:
Eller ja syret har ju 6 valenselektroner, men den har ju en extra elektron som gör att det blir -1? En elektron kommer ju från H. Då tänker jag att de andra 7 borde komma från syre. O har ju sitt skal med 8 valenselektroner. Hur kan då reaktion ske?
Jag räknar till 8 elektroner kring syreatomen. 6 stycken som "härstammar" från syret, en som kommer från väteatomen och en som är den extra negativa laddningen.
Smaragdalena skrev:sund20 skrev:Smaragdalena skrev:Varför skulle syret ha 7 valenselektroner, menar du?
Alltså syre har väl 6 valenselektroner vanligtvis, men OH har väl 8 valenselektroner totalt? Det är denna bilden jag tänker på:
Eller ja syret har ju 6 valenselektroner, men den har ju en extra elektron som gör att det blir -1? En elektron kommer ju från H. Då tänker jag att de andra 7 borde komma från syre. O har ju sitt skal med 8 valenselektroner. Hur kan då reaktion ske?
Jag räknar till 8 elektroner kring syreatomen. 6 stycken som "härstammar" från syret, en som kommer från väteatomen och en som är den extra negativa laddningen.
Men hur kan den då reagera med en annan elektron (som finns hos kolet). Borde inte syret vara "nöjd" nu? Om den har 6 st själv, den delar en med väte och den har "fått" en som ger en negativ laddning, då har den ju 8 valenselektroner. Jag förstår inte då varför/hur den reagerar med C? Den har ju redan fullt skal? Först tänkte jag att båda elektronerna i bindningen till C då kanske kommer från O, men det stämmer ju inte heller för C har ju en ensam valenselektron?
Hydroxidjonen är negativt laddad. Om den hittar nånting som är positivt laddat, så...
Smaragdalena skrev:Hydroxidjonen är negativt laddad. Om den hittar nånting som är positivt laddat, så...
Så kolet är positivt laddat? Eller varför binder den in där? Och om det nu är så, vad händer med den överblivna elektronen? För någonstans måste ju den nionde elektronen ta vägen (antingen av syrets elektroner eller kolets fria elektron) när det uppstår en bindning mellan kol och syre? För de är väl bundna kovalent?
Vilken reaktion är det du menar?
Smaragdalena skrev:Vilken reaktion är det du menar?
Jag menar reaktionen mellan OH och C, så att det bildas etanol? O har ju 8 elektroner i sitt skal (fullt), C har en fri elektron. Hur kan det då bildas en kovalent bindning, det blir ju 9 elektroner för O?
Vilka reaktanter menar du?
Smaragdalena skrev:Vilka reaktanter menar du?
Hur menar du med reaktanter? Jag menar om OH ska binda in till etylgruppen, d.v.s. som vid etanol. Jag förstår inte hur det går till eftersom kolet har 4 valenselektroner (7 med bindningarna), den kan alltså skapa en till bindning. Men det bygger väl på att den valenselektronen isf ingår i den "nya" kovalenta bindningen till O. O har ju redan 8 valenselektroner. Om den gör en kovalent bindning med C så får den 9 elektroner.
sund20 skrev:Smaragdalena skrev:Vilka reaktanter menar du?
Hur menar du med reaktanter? Jag menar om OH ska binda in till etylgruppen, d.v.s. som vid etanol. Jag förstår inte hur det går till eftersom kolet har 4 valenselektroner (7 med bindningarna), den kan alltså skapa en till bindning. Men det bygger väl på att den valenselektronen isf ingår i den "nya" kovalenta bindningen till O. O har ju redan 8 valenselektroner. Om den gör en kovalent bindning med C så får den 9 elektroner.
Eller man räknar inte med den elektronen som ger -1 laddningen? Fast på alla bilder så är elektronen centrerad kring just O, så det gör ju att O får 8 valenselektroner? Jag har försökt leta lite på nätet och hittat lite om att det blir en fri elektron vid kolet om väte tas bort med strålning. Medan det blir substitution av väteatomen i etan och ersätts med hydroxigrupp som gör en nukleofil attack på kol i etan. Så då innebär det att bindningen mellan O och C helt och hållet kommer från O's elektroner? För man räknar här som att C inte har den fria elektronen?
sund20 skrev:sund20 skrev:Smaragdalena skrev:Vilka reaktanter menar du?
Hur menar du med reaktanter? Jag menar om OH ska binda in till etylgruppen, d.v.s. som vid etanol. Jag förstår inte hur det går till eftersom kolet har 4 valenselektroner (7 med bindningarna), den kan alltså skapa en till bindning. Men det bygger väl på att den valenselektronen isf ingår i den "nya" kovalenta bindningen till O. O har ju redan 8 valenselektroner. Om den gör en kovalent bindning med C så får den 9 elektroner.
Eller man räknar inte med den elektronen som ger -1 laddningen? Fast på alla bilder så är elektronen centrerad kring just O, så det gör ju att O får 8 valenselektroner? Jag har försökt leta lite på nätet och hittat lite om att det blir en fri elektron vid kolet om väte tas bort med strålning. Medan det blir substitution av väteatomen i etan och ersätts med hydroxigrupp som gör en nukleofil attack på kol i etan. Så då innebär det att bindningen mellan O och C helt och hållet kommer från O's elektroner? För man räknar här som att C inte har den fria elektronen?
Eller jag förstår inte hur det går ihop att en atom med 8 valenselektroner kan binda till en atom som har en fri valenselektron? Den fria valenselektronen måste ju bort då (om det nu är möjligt att bindningen enbart kan bestå av elektroner från den ena atomen, vilket jag inte vet, eller om den alltid måste bestå av en elektron från vardera). 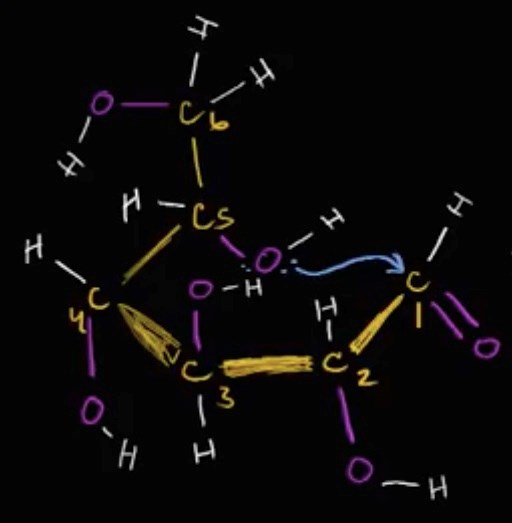
Om man t.ex. tittar på den här bilden med glukos så ser det ju ut som att O vid kol 5 enbart har 8 valenselektroner, 6 egna, varav 4 är fria och 2 st sitter i bindningar med varsin annan elektron (som kommer från H och C) vilket gör att den totalt (med sina bindningar till både kol och väte) får 8 valenselektroner. Det skulle ju innebära att OH har 7 valenselektroner från början, och sedan får 1 när den binder till C.
sund20 skrev:Smaragdalena skrev:Vilka reaktanter menar du?
Hur menar du med reaktanter? Jag menar om OH ska binda in till etylgruppen, d.v.s. som vid etanol. Jag förstår inte hur det går till eftersom kolet har 4 valenselektroner (7 med bindningarna), den kan alltså skapa en till bindning. Men det bygger väl på att den valenselektronen isf ingår i den "nya" kovalenta bindningen till O. O har ju redan 8 valenselektroner. Om den gör en kovalent bindning med C så får den 9 elektroner.
Det finns inga fria etylgrupper som kan reagera.
Molekylerna bryr sig inte om varifrån elektronerna kommer från början.
Om en hydroxidjon OH- binder till en oladdad molekyl så får produkten laddningen -1.
Eller menar du (en oladdad) hydroxigrupp?
Smaragdalena skrev:sund20 skrev:Smaragdalena skrev:Vilka reaktanter menar du?
Hur menar du med reaktanter? Jag menar om OH ska binda in till etylgruppen, d.v.s. som vid etanol. Jag förstår inte hur det går till eftersom kolet har 4 valenselektroner (7 med bindningarna), den kan alltså skapa en till bindning. Men det bygger väl på att den valenselektronen isf ingår i den "nya" kovalenta bindningen till O. O har ju redan 8 valenselektroner. Om den gör en kovalent bindning med C så får den 9 elektroner.
Det finns inga fria etylgrupper som kan reagera.
Molekylerna bryr sig inte om varifrån elektronerna kommer från början.
Om en hydroxidjon OH- binder till en oladdad molekyl så får produkten laddningen -1.
Eller menar du (en oladdad) hydroxigrupp?
Jag vet inte, är OH som sitter i alkoholer en hydroxigrupp eller en hydroxijon? Vi har benämnt den som en hydroxigrupp hela tiden, men när man googlar så är det ju främst bilder på en laddad hydroxijon så jag antog att det var en sådan som ingick i alkoholer m.m. Men jag kanske blandade ihop det där. För om det istället är en hydroxigrupp (7 valenselektroner) så förstår jag ju hur den skulle kunna binda in till kol. Är det hydroxigrupper i alkoholer, karboxylsyror m.m?
Hydroxidjonerna hör (mest) hemma i den oorganiska kemin. I organisk kemi är det hydroxigrupper det handlar om - det som blir kvar av en vattenmolekyl om man tar bort en väteatom, på samma sätt som en etylgrupp är det som blir kvar av en etanmolekyl om man tar bort en väteatom. Då finns det en oparad elektron ( i varje) som HUNGRAR efter sällskap! Men varken hydroxigrupper eller etylgrupper existerar som fria ämnen i verkligheten.


