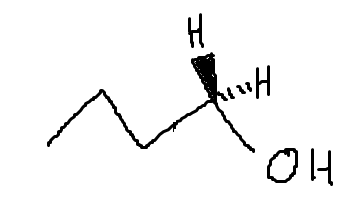
Fråga om E2 reaktion
Hej! Har en fråga om en reaktionsmekanism där en alkohol blir en alken med hjälp av en syra genom E2! Har för mig att E2 sker genom ett enda reaktionssteg, men jag kan inte riktigt lyckas få slutprodukten med bara ett, behöver typ ett steg där alkoholen aktiveras och sedan ett till där H2O spjälkas av, skulle detta då räknas som att eliminationsreaktionen gått genom 2 reaktionssteg och då vara fel?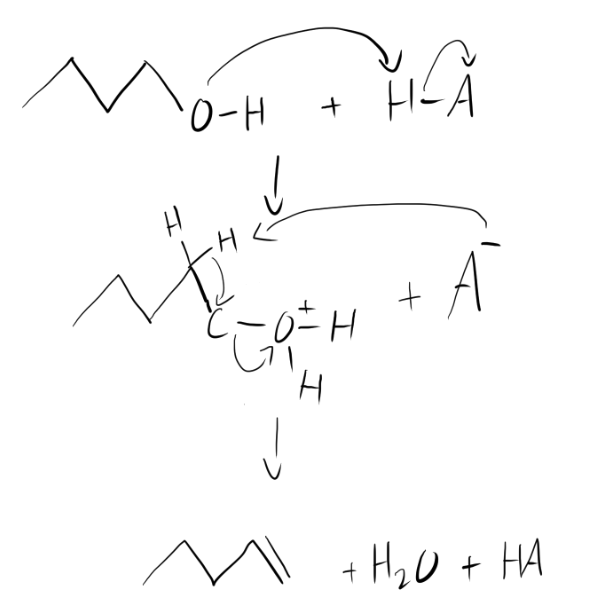
Din mekanism ser ok ut.
Kolla §8 här: https://www.masterorganicchemistry.com/2015/04/16/elimination-reactions-of-alcohols/
Man kallar E2 (kanske lite slarvigt) för ett steg, då man bara ett transition state (TS), dvs en pil från reaktanterna till TS o sen en pil från TS till slutproduklterna.
PS: Notera att §8 är lite vag i beskrivningen med flera "likely" ;)
Basen attackerar med en negativ laddning (antingen partiell eller permanent) ett väte som sitter antiperiplanärt mot den lämnande gruppen.
Här är jag däremot lite konfunderad. Så som detta är ritat finns det inget väte med rätt geometri jämfört med den lämnande gruppen (H2O)? Den lämnande gruppen ligger i planet så för att ett väte ska ha rätt geometri måste detta också ligga i planet. Båda vätena som finns tillgängliga pekar dock in i och ut ur planet:
Men jag kanske tänker knasigt.
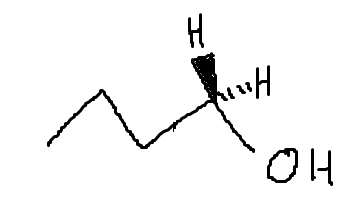
naytte skrev:Basen attackerar med en negativ laddning (antingen partiell eller permanent) ett väte som sitter antiperiplanärt mot den lämnande gruppen.
Här är jag däremot lite konfunderad. Så som detta är ritat finns det inget väte med rätt geometri jämfört med den lämnande gruppen (H2O)? Den lämnande gruppen ligger i planet så för att ett väte ska ha rätt geometri måste detta också ligga i planet. Båda vätena som finns tillgängliga pekar dock in i och ut ur planet:
Men jag kanske tänker knasigt.
Nej du tänker helt rätt!
Bindningen för det väte som basen tar, behöver ligga i samma plan som den bindningen som bryts (den mellan C-OH2+). Det går dock med både antiperiperiplanärt (lägst energi, mer sannolik att reaktionen ske med denna) och syn- (högre energi, mindre sannolikt att detta sker). Men detta känns mer som universitetskemi än Ke2.
@Pannkakan: Du har en metylengrupp (CH2) för mycket i inlägg #1, som dyker upp på raderna 2-3, så produkten blir en pent-1-en istället för den förväntade but-1-en.
mag1 skrev:naytte skrev:Basen attackerar med en negativ laddning (antingen partiell eller permanent) ett väte som sitter antiperiplanärt mot den lämnande gruppen.
Här är jag däremot lite konfunderad. Så som detta är ritat finns det inget väte med rätt geometri jämfört med den lämnande gruppen (H2O)? Den lämnande gruppen ligger i planet så för att ett väte ska ha rätt geometri måste detta också ligga i planet. Båda vätena som finns tillgängliga pekar dock in i och ut ur planet:
Men jag kanske tänker knasigt.
Nej du tänker helt rätt!
Bindningen för det väte som basen tar, behöver ligga i samma plan som den bindningen som bryts (den mellan C-OH2+). Det går dock med både antiperiperiplanärt (lägst energi, mer sannolik att reaktionen ske med denna) och syn- (högre energi, mindre sannolikt att detta sker). Men detta känns mer som universitetskemi än Ke2.
@Pannkakan: Du har en metylengrupp (CH2) för mycket i inlägg #1, som dyker upp på raderna 2-3, så produkten blir en pent-1-en istället för den förväntade but-1-en.
Whops slarvade till det där! Men det med hur allt sitter i olika plan tror jag inte vi gått genom :(
Alla molekyler har ju en tredimensionell struktur som beror på hur dess atomer pekar i rymden, och detta är viktigt för en E2-mekanism. Den feta "kil"bindningen innebär att bindningen pekar ut mot oss och den streckade bidningen betyder att bindningen pekar in i planet, "bort från oss". En vanlig linje innebär att bindningen ligger i planet. Om du medvetet gör synen "suddig" (genom att "unfocus" med ögonen) kanske du kan känna den tredimensionella strukturen i bilden jag komponerade ovan.
För att en E2-mekanism ska äga rum krävs oftast att β-vätet som abstraheras ligger i samma plan som den lämnande gruppen. Som du ser ligger däremot inget sådant väte i samma plan som den lämnande gruppen (OH2+). Men tydligen finns det undantag!