Hjälp med förtydligande
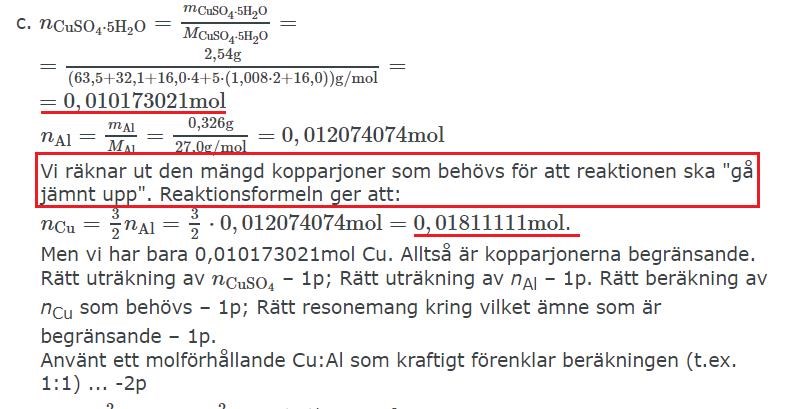
I ett försök löser du 2,06 g kristalliserad kopparklorid, CuCl2·2H2O, i 50,0 ml vatten. I kopparkloridlösningen stoppar du ner en bit aluminium med massan 0,107 g Då sker det en reaktion.
3Cu2+(aq) + 2Al(s) → 3Cu(s) + 2Al3+(aq)
Frågan är vilket ämne som tar slut först, alltså vilken som är begränsad. Jag undrar om jag får en uppgift på provet liknande denna, ska jag då först ta ut substansmängden för båda ämnena, sedan kolla substansmängd förhållandet och till sist ta fram hur mycket som krävs för att reaktionen ska gå "jämt ut" men hur kan jag veta vilket ämne jag ska testa som går "jämt ut"? Det fasta ämnet som läggs i lösningen eller?
Är också lite förvirrad varför ämnet är begränsat om 0,01811111 > 0,010173021 mol? Är 0,010173021 substansmängden vi har? Och det andra substansmängden vi behöver för att jämna ut reaktionen men vi har alltså inte så mycket? Förlåt om det låter förvirrande. Vill gärna förstå uppgiften
Du har redan en tråd om den här frågan - fortsätt där. Det står i Pluggakutens regler att man bara får ha en tråd om varje fråga. Tråden låses. /moderator


