Hur finner man ifall ett ämne är resonansstabiliserad?
Hur vet man ifall ett ämne är resonansstabiliserad hur skall man gå tillväga för att komma till den slutsattsen? Ta som exempel anianiliniumjon varför är denna inte resonans stabiliserad med exempelevis toluen är?
Jag tänker att elektrionerna borde ju fortfarande kunna flyttas från "dubbelbidnignarna" i bensenringen upp och binda med en dubbelbinding.
Det här kan man gräva djupt i om man vill. Det enklaste på gymnasienivå är att rita upp Lewis-strukturen så ser du om -elektronerna (elektronerna i dubbelbindningen) kan sitta på olika ställen i molekylen.
Pikkart skrev:Det här kan man gräva djupt i om man vill. Det enklaste på gymnasienivå är att rita upp Lewis-strukturen så ser du om -elektronerna (elektronerna i dubbelbindningen) kan sitta på olika ställen i molekylen.
Då frågar jag den motsatta frågan, när kan elektronerna i dubbelbindnigen inte sitta på olika ställen? Som ifallet med anialiniumjonen, en bensen ring och en NH3+ bundet till sig, varför kan inte elektronerna dubbelbinda sig till kvävet?
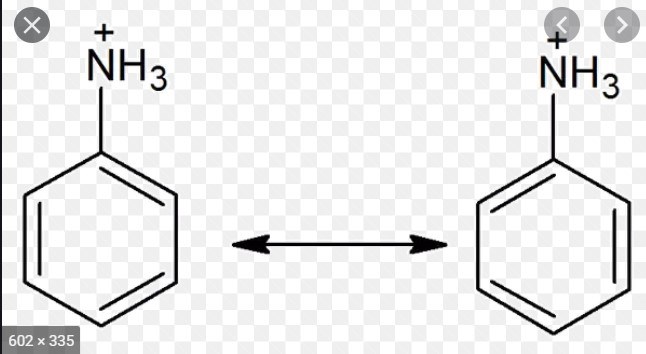
För att om du kastar upp en av bindningarna som en dubbelbindning mot kväve så har kväve 5 bindningar - är det möjligt?
Pikkart skrev:
För att om du kastar upp en av bindningarna som en dubbelbindning mot kväve så har kväve 5 bindningar - är det möjligt?
Nja, den kan ju inte ha 4st, men i mitt huvud så tänker jag att för att laddning ska vara 0, behvövs en till elektron i NH3, därför kan man kanske flytta elektronert till de? Det samma kan man väl även säga om toluen. Kol kan ju bara ha 4, men det får ju 5 i toluen? Tänker jag fel?
Jo, kväve kan forma 4 bindningar men inte 5. Det stämmer att laddningen blir 0 om det kommer en till dubbelbindning dit men kväve kan inte forma 5 bindningar - dvs. för att kväve ska bli neutralt laddad så krävs att ett väte försvinner och att bindningen lägger sig som ett delokaliserat elektronpar (dubbelbindning) på kvävet.
Problemet är att du inte kan flytta en elektron dit - hur hade du gjort det?
Vart får kol 5 bindningar i toluen?
Pikkart skrev:Jo, kväve kan forma 4 bindningar men inte 5. Det stämmer att laddningen blir 0 om det kommer en till dubbelbindning dit men kväve kan inte forma 5 bindningar - dvs. för att kväve ska bli neutralt laddad så krävs att ett väte försvinner och att bindningen lägger sig som ett delokaliserat elektronpar (dubbelbindning) på kvävet.
Problemet är att du inte kan flytta en elektron dit - hur hade du gjort det?Vart får kol 5 bindningar i toluen?
Toluen har ju en metylgrupp bundet till sig, eftersom den har resonanstruktur kommer dubbelbindnigen att slå upp till metylgruppen, detta skapar fem bindnignar, tre enkelbindniganr och 1 dubbelbindning? Detsamma resonemanget jag kör kan väl även appliceras på kvävet?
Du tänker ju helt rätt egentligen men ett väte "lossnar" och därför har kolet alltid bara 4 bindningar. Det är lite abstrakt kan jag tänka mig.
Pikkart skrev:Du tänker ju helt rätt egentligen men ett väte "lossnar" och därför har kolet alltid bara 4 bindningar. Det är lite abstrakt kan jag tänka mig.
Vänta lite nu, är vi på samma tankebana här? Toluen = resonansstruktur, anialiniumjonen = har inte resonans. Lossnar väte på båda? då är det väl inte resonans?
Jag var nog för snabb men jag övertänkte att en benzylradikal skulle bildas - men här gjorde jag resonansstabiliseringen av toluen.
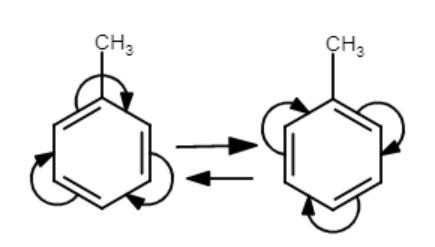
Ok vi skippar allt vi har pratat om tidigare, för allt det är baserat på antagandet att aliniumjonen ej kan resonansstabiliseras vilket det kan. Finns det någon metod att finna vilka ämnen som är resonansstabiliserade
Leta efter olika sätt att rita molekylen, typ. Leta speciellt efter dubbelbindningar.
En karboxylsyra är ett bra exempel. Karboxylgruppen består av ett dubbelbundet syre till ett kol och en OH-grupp. Om ett H+ avges har man ett dubbelbundet syre och ett enkelbundet syre med en extra elektron.
Det finns ingenting som hindrar dig från att rita det ena syret dubbelbundet och det andra enkelbundet med en minusladddning, eller tvärt om. Eftersom båda sätten är möjliga vet man inte vilken som är ”korrekt”. Du har då två möjliga resonansstrukturer och sanningen är ett mellanting mellan de två formerna. Eftersom minusladdningen är utspridd på två syren blir jonen mer stabil och mindre reaktionsbenägen än om elektronen satt koncentrerad på ett enda syre.
Bensen är ett annat exempel. Där kan du rita ringen med tre enkelbindningar och tre dubbelbindningar, men du kan rita detta på två olika sätt. Det råder alltså en osäkerhet kring var de extra bindningselektronerna befinner sig. De är delokaliserade och befinner sig ”överallt” i ringen hela tiden. Eftersom det inte finns dubbelbindningar, dvs mer elektrontäta områden på specifika platser blir även bensen mer stabil och mindre reaktionsbenägen. Man kan t.ex. inte addera brom till bensen på samma sätt som man kan göra med hexen som innehåller lika många kolatomer och dubbelbindningar, fast på bestämda platser.




