Hur se skillnad på sp^2- och sp^3-hybridisering
Hej!
Hur kan man säkert veta om en atom är sp2- och sp3-hybridiserad, om atomen som man ska analysera har två fria elektronpar?
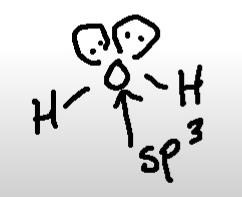
H2O är sp3-hybridiserad. Men varför måste det vara så? Jag ser inget hinder mot att den skulle kunna vara sp2-hybridiserad. Jag tänker mig liksom att ett av de fria elektronparen är en pi-orbital medan det andra fria elektronparet är en sigma-orbital.
Du ser det på geometrin. Vid sp2 får man tre sp2-orbitaler som ligger i samma plan med en vinkelrät p-orbital. Vid sp3 har du fyra sp3-orbitaler som bildar en tetraeder (som i det här fallet).
Teraeagle skrev:Du ser det på geometrin. Vid sp2 får man tre sp2-orbitaler som ligger i samma plan med en vinkelrät p-orbital. Vid sp3 har du fyra sp3-orbitaler som bildar en tetraeder (som i det här fallet).
Okej. Hur kan jag se att alla orbitalerna på bilden verkligen ligger som en tetraeder? Ser det annorlunda ut om man skulle rita upp det så att tre sp2-orbitaler ligger i samma plan med en vinkelrät p-orbital? Jag skulle ju kunna se skillnad i 3d, men inte om man ritade det som på bilden som jag lade ut.
Det är en följd av VSEPR-teorin:
https://sv.wikipedia.org/wiki/VSEPR-teorin
Du har fyra elektrontäta områden runt syret och dessa vill komma så långt ifrån varandra som möjligt, dvs bilda en tetraeder. Om syret var sp2-hybridiserat skulle det se ut ungefär som ”trigonal bipyramid” med tre fria elektronpar.
Sen förutspår VSEPR också att fria elektronpar repellerar lite mer än bindande elektronpar och därför blir bindningsvinkeln mellan väteatomerna lite mindre än de 109 grader man kan förvänta sig med fyra bindande elektronpar (t.ex. i metan). Om man gör experiment ser man att bindningsvinkeln är ungefär 104,5 grader. Det förklarar man genom att syret är sp3-hybridiserat med två fria elektronpar.
Hybridisering är ju något man tar till för att förklara något man observerar, det är inte så att man helt och hållet kan klura ut på förhand hur molekylen ser ut. Man kan t.ex. tro att vätesulfid (H2S) har en likadan struktur som vatten eftersom svavel och syre ligger i samma grupp och därför har lika många valenselektroner. Men så är det inte, bindningsvinkeln i H2S är nästan 90 grader. Utifrån det har man dragit slutsatsen att svavlets orbitaler i vätesulfid inte är hybridiserade över huvud taget.
Teraeagle skrev:Det är en följd av VSEPR-teorin:
https://sv.wikipedia.org/wiki/VSEPR-teorin
Du har fyra elektrontäta områden runt syret och dessa vill komma så långt ifrån varandra som möjligt, dvs bilda en tetraeder. Om syret var sp2-hybridiserat skulle det se ut ungefär som ”trigonal bipyramid” med tre fria elektronpar.
Sen förutspår VSEPR också att fria elektronpar repellerar lite mer än bindande elektronpar och därför blir bindningsvinkeln mellan väteatomerna lite mindre än de 109 grader man kan förvänta sig med fyra bindande elektronpar (t.ex. i metan). Om man gör experiment ser man att bindningsvinkeln är ungefär 104,5 grader. Det förklarar man genom att syret är sp3-hybridiserat med två fria elektronpar.
Hybridisering är ju något man tar till för att förklara något man observerar, det är inte så att man helt och hållet kan klura ut på förhand hur molekylen ser ut. Man kan t.ex. tro att vätesulfid (H2S) har en likadan struktur som vatten eftersom svavel och syre ligger i samma grupp och därför har lika många valenselektroner. Men så är det inte, bindningsvinkeln i H2S är nästan 90 grader. Utifrån det har man dragit slutsatsen att svavlets orbitaler i vätesulfid inte är hybridiserade över huvud taget.
Menar du inte två fria elektronpar? Sp2-hybridisering av syre tycker jag borde ge två fria elektronpar.
Förresten, jag har en till fråga om just Sp2-hybridisering av syre:
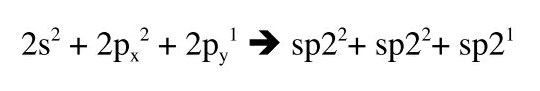
Vad är skälet till att p-orbitalen med två elektroner ingår i hybridiseringen? Syre har ju två p-orbitaler med vardera 1 elektron och en p-orbital med 2 elektroner. Så det skulle inte behövas att p-orbitalen med 2 elektroner hybridiseras. Tänk om det stod 2s^2 + 2p^1 + 2p^1 i det vänstra ledet i bilden i stället. Då skulle π-bindningen vara ett fritt elektronpar. Varför är det inte på detta sätt?
I en syremolekyl finns det två oparade molekyler, annars skulle inte syrgas vara så reaktivt som det är. Man behöver anpassa modellen så att den kan förklara att det är så.
Jag menade två fria elektronpar, men det är fortfarande så att symmetrin inte går ihop om syret var sp2-hybridiserat.




