Hur ser glycin, asparginsyra och lysin ut vid pH 7?
Hur
Hur ser glycin, asparginsyra och lysin ut vid pH 7?
Det står säkert i din lärobok, och det står i Wikipedia. Google är också bra. Du behöver lära dig att ta reda på fakta själv!
Trodde
Elsa000, det står i Pluggakutens regler att du skall visa hur du har försökt och långt du har kommit, och att du skall hålla en god ton. /moderator
Elsa000, det är mycket otacksamt och ohyfsat av dig att radera ditt inlägg. /moderator
Hur ser glycin, asparginsyra och lysin ut vid pH 7?
Jag kände mig dumförklarad av ditt svar och ville inte ha kvar min fråga och såg ingen vitts med det då inget svar på frågan gavs
Meningen med Pluggakuten är att du skall få den hjälp du behöver för att kunna lösa din fråga själv, och det är precis vad du har fått av mig, anser jag, Meningen med Pluggakuten är inte att jag skall göra din a läxor åt dig.
Kunde inte lösa min fråga själv, just därför jag frågade om hjälp. Sökte på Google och Wikipedia och hittade inget i min bok. Fick upp massa olika bilder på hur dom såg ut när jag sökte och meningen med min fråga var att försöka fatta varför dom ser ut som dom gör vid olika pH för att sedan kunna använda mig av kunskaperna till att rita dom själv. Men tack för ditt svar:)
Om du hade beskrivit vad du hade hittat och varför detta inte var svar på din fråga, skulle du ha fått hjälp med detta. Du har fortfarande chansen. ;-)
Samtliga aminosyror (inklusive dina exempel i denna tråd) har en amino- och en karboxylgrupp, och vid pH 7 kommer den sura karboxylgruppen protolyseras (COOH => COO-) och aminogruppen kommer att ta upp en proton (NH2 => NH3+), så vid pH 7 ser de ut så här:
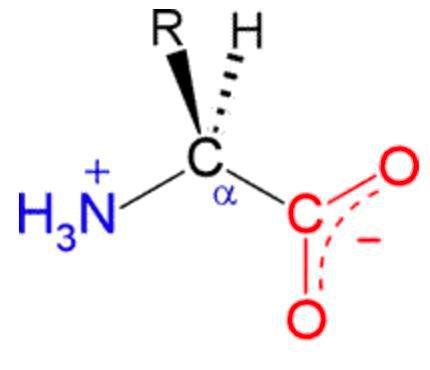
De individuella aminosyrorna har varsin unik R-grupp, och denna kan innehålla en grupp som kan ta upp eller lämna ifrån sig protoner beroende på pH (precis som amino- och karboxylgrupperna som alla aminosyror har).
Vid pH 7 har de sura aminosyrornas R-grupp protolyserats, och de basiska aminosyrornas R-grupp har tagit upp en till proton.
Kommer du vidare nu?
Ja förstår nu tror jag, tack för hjälpen!
Okej är lite förvirrad igen
Som jag fattat det nu så kommer den sura karboxylgruppen från asparginsyran protolyseras och aminogruppen kommer ta upp karboxylgruppens avgivna väte? Så det blir COO- och NH3+
Sen om jag ska kolla på r-gruppen till varje aminosyra (som ser olika ut för varje aminosyra?) så vet jag att asparginsyra är en sur aminosyra då den har en Ip runt pH 3. Alltså kommer väll R-gruppen protolyserad, avge ett väte. Jag undrar nu hur jag vet vilket väte som avges? För att om jag ska rita upp hur asparginsyra ser ut vid pH 7 så ritar jag väll upp så det ser ut som den bilden du skicka men istället för R sätter jag väll in asparginssyrans specifika R-grupp? Som jag tar bort ett H från?
Elsa000 skrev:Okej är lite förvirrad igen
Som jag fattat det nu så kommer den sura karboxylgruppen från asparginsyran protolyseras och aminogruppen kommer ta upp karboxylgruppens avgivna väte? Så det blir COO- och NH3+
Det stämmer.
Sen om jag ska kolla på r-gruppen till varje aminosyra (som ser olika ut för varje aminosyra?) så vet jag att asparginsyra är en sur aminosyra då den har en Ip runt pH 3. Alltså kommer väll R-gruppen protolyserad, avge ett väte. Jag undrar nu hur jag vet vilket väte som avges? För att om jag ska rita upp hur asparginsyra ser ut vid pH 7 så ritar jag väll upp så det ser ut som den bilden du skicka men istället för R sätter jag väll in asparginssyrans specifika R-grupp? Som jag tar bort ett H från?
Det finns väl bara ett väte på aspariginsyrans sidokedja som "är surt"?
Elsa000 skrev:Okej är lite förvirrad igen
Som jag fattat det nu så kommer den sura karboxylgruppen från asparginsyran protolyseras och aminogruppen kommer ta upp karboxylgruppens avgivna väte? Så det blir COO- och NH3+
Precis.
Sen om jag ska kolla på r-gruppen till varje aminosyra (som ser olika ut för varje aminosyra?) så vet jag att asparginsyra är en sur aminosyra då den har en Ip runt pH 3.
Jo det gäller den isoelektriska punkten. Men du får titta på aminosyrans pKa värden, som för basiska och sura aminosyror är tre - en för varje grupp (karboxyl-, amin- och R-gruppen).
För karboxyl- och aminogruppen gäller, som jag skrev tidigare, att de pH 7 att de är laddade. Om du tittar på aminosyrornas pKa finner du att deras karboxylgrupper har pKa under 3, och pKa är högre än 8 för aminogruppen - därför ser de ut som bilden jag klistrade in tidigare.
Då karboxyl- och aminogruppernas laddningar tar ut varandra vid pH, kommer R-gruppens pKa avgöra aminosyras laddning.
Alltså kommer väll R-gruppen protolyserad, avge ett väte. Jag undrar nu hur jag vet vilket väte som avges? För att om jag ska rita upp hur asparginsyra ser ut vid pH 7 så ritar jag väll upp så det ser ut som den bilden du skicka men istället för R sätter jag väll in asparginssyrans specifika R-grupp? Som jag tar bort ett H från?
Ja det enda som skiljer är R-gruppen, och som du listat ut kommer den för asparginsyran vara protolyserad vid pH 7 (precis som karboxylgruppen).
Nu har jag ritat dom och fattar tack för hjälpen!!


