hur vet man att det är en syra?
Funderade på en grej jag kom på. Hur vet man att det är en syra genom att se molekylen? Vet att det är en syra om den vill avge positiva vätejoner i en lösning. Men hur vet jag om den gör det?
Ta tex stearinsyra 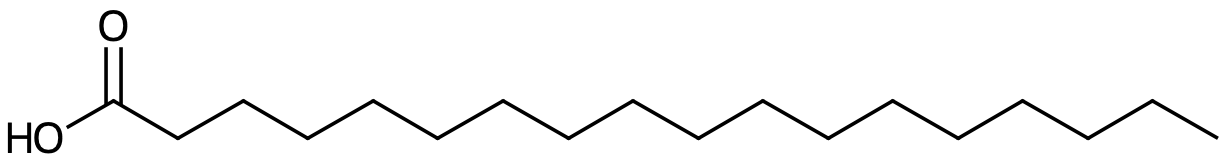
Var i den här ser jag att den vill avge. Beror det på att den har vätebindning vill lösa sig i vatten? Varför just positiva vätejoner isåfall?
Tack i förhand!!
Du måste lära dig att känna igen karboxylgruppen (längst till vänster). Den har möjlighet att avge en vätejon och finns i alla karboxylsyror, inklusive fettsyror.
Teraeagle skrev:Du måste lära dig att känna igen karboxylgruppen (längst till vänster). Den har möjlighet att avge en vätejon och finns i alla karboxylsyror, inklusive fettsyror.
ok! varför har den möjlighet att avge en vätejon?
Karboxylatjonen som bildas när det avges ett H+ är resonansstabiliserad. Du kan se det som att dubbelbindningen kan ”hoppa” mellan syreatomerna. Motsvarande princip gäller för den extra elektronen som ger jonen dess laddning. När det finns möjlighet att sprida ut en laddning på det sättet blir ämnet mer energimässigt stabil och gynnsam att bilda.
Teraeagle skrev:Karboxylatjonen som bildas när det avges ett H+ är resonansstabiliserad. Du kan se det som att dubbelbindningen kan ”hoppa” mellan syreatomerna. Motsvarande princip gäller för den extra elektronen som ger jonen dess laddning. När det finns möjlighet att sprida ut en laddning på det sättet blir ämnet mer energimässigt stabil och gynnsam att bilda.
hmm, förstår inte riktigt men ska klura lite på det och se om det lossnar efter en stund.
Teraeagle skrev:Karboxylatjonen som bildas när det avges ett H+ är resonansstabiliserad. Du kan se det som att dubbelbindningen kan ”hoppa” mellan syreatomerna. Motsvarande princip gäller för den extra elektronen som ger jonen dess laddning. När det finns möjlighet att sprida ut en laddning på det sättet blir ämnet mer energimässigt stabil och gynnsam att bilda.
Fattar lite nu! Men inte riktigt med elektronen, hoppar elektronen mellan andra väte eller? Varför sker dessa saker i en lösning och inte annars?
Det kan bli resonans i en karboxylatjon men inte i karboxylsyran, eftersom det bara finns ett enda sätt att få elektronerna att stämma i karboxylsyran - dubbelbindningen måste ju vara där det inte finns något väte.



