Idé till gymnasiearbete 2 - munvattens påverkan på förekomst av nitrit i munhålan
Hej, Pluggakuten!
För ett tag sedan stötte jag på en intressant artikel där det beskrevs hur vissa typer av antiseptiska eller på annat vis antibakteriella munvatten kan försämra hälsan genom att de dödar bakterier som främjar hälsan. Främst handlade artikeln om bakterier som bröt ned nitrat till nitrit i saliven. När nitriten väl sväljs bildas kväveoxid, som är viktigt för b.la. blodkärlen och kan motverka högt blodtryck.
Nu till själva idén:
Man kanske skulle kunna framställa några olika typer av munvatten, alltså några slags "generella" munvatten (på samma sätt som rost kan "generaliseras" till FeOOH). Dessa skulle man sedan eventuellt kunna testa på bakterieodlingar och mäta halten nitrit.
Att framställa några typer av primitiva munskölj kan jag inte föreställa mig är så värst svårt (de får då såklart gärna likna de massproducerade munsköljen man kan köpa i affären). Men problemet blir, tror jag, just att mäta nitrithalter och dessutom att få rätt slags bakterier i bakterieodlingarna. Detta är såklart bara en outvecklad idé, men tror ni att något i denna stil skulle vara genomförbart eller skulle det vara att ta sig vatten över huvudet?
Tack på förhand och ha en fortsatt fin vecka!
Bra idé, men jag tror det blir svårt att genomföra i praktiken. Dels eftersom det är svårt att mäta nitrithalten på ett bra sätt, dels eftersom skolor brukar vara ovilliga att odla fram "okända" bakterier. Det finns en risk att man odlar fram patogena bakterier.
Det var något sådant jag misstänkte… Men säg att bakterierna inte vore något problem, hur skulle man kunna bära sig åt för att mäta nitrithalten? Hur gör man vanligtvis i mer utrustade labb?
Det vet jag tyvärr inte, men det borde gå att söka fram på nätet? När jag hade akvarium vet jag att man kunde köpa teststickor för att mäta nitrithalten i vattnet. Du skulle kunna kolla ungefär vilka halter de kan mäta, eller försöka hitta någon litteratur som beskriver hur de fungerar.
Okej, förstår! Ska kolla runt på nätet och återkomma!
Skulle du kunna odla munbakterier från dig själv? Då är risken ganska liten att du odlar fram någon superbakterie, och smittrisken är liten eftersom du redan har dem i munnen. Kanske skulle du till och med kunna få lite bakterier från några i din närhet, för att få några olika bakteriefloror. Hör med din lärare - hen vet säkert vilka regler som gäller.
Bakteriefloran i munnen är komplex och det finns flera växtytor, som var och en har en egen variant av bakterieflora (d.v.s. floran skiljer sig mellan t.ex. tungan, kinden, tändernas yta, tandfickor etcetera).
Det är många olika arter som lever och samverkar på en och samma yta, bl.a. genom att bilda dem biofilm som bakterierna kan leva i. Mellan arterna sker även en konkurrens om växtplats, näring, och vissa arter gynnas av andra arters närvaro (t.ex. genom att utnyttja en annan arts biofilmskomponenter eller lägga till egna komponenter, med en bättre livsmiljö som resultat).
Miljön i munhålan är på vissa ställen syrefattig, speciellt i tandfickorna, och inuti biofilmerna. Därför kan anaeroba bakterier trivas bra mellan tänderna, och där bilda bl.a svavelföreningar och annat som luktar illa. Så lite beroende på var bakterieprover tas, kommer lite olika uppsättningar av bakterier att fås, även om många bakterier kan finnas på flera ytor samtidigt. Det finns kit för att odla bakterier anaerobt i påse (tillsammans med oxiderande tillsats), så det går teoretiskt att välja att odla både med och utan syre.
Du kanske t.o.m. kan lista ut ett sätt att odla bakterierna i vätska istället för på platta. För odlar du bakterierna i vätska, kan du mäta antalet bakterier och få samma koncentration/mängd bakterier, innan du tillsätter nitrit för att se nedbrytningen minskar. I ditt experiment finns annars risken att antalet bakterier minskar generellt efter behandling med "munskölj", vilken borde leda till att nitritnedbrytningen minskar generellt - inte specifikt för att vissa bakterier minskar till antal.
Bestämma koncentrationen av nitrit går t.ex. med Griess test eller variant av det, och finns det tillgång till en spektrofotometer kan även koncentrationen mätas kvantitativt.
Ligger lite utanför ett gy-arbete, men en annan fråga är vilka bakterier som ersätter de nitratnedbrytande bakterierna? För drabbas vissa bakterier, minskar konkurrensen mellan bakterierna, och de som inte drabbas kan då sprida ut sig mer.
Hej! Står och väger mellan att skriva om detta eller om matematik, men jag kom just på att vi faktiskt har spektrofotometrar i labbet. Men hur menar du att jag skulle kunna undersöka nitrithaltens minskning med spektrofotometer?
Om jag skulle behandla ett vätskeprov med "munskölj", hur lång tid tror du att det skulle ta innan man börjar se skillnad i nitritbildning? Och hur exakt skulle det gå att mäta med spektrofotometer?
Tillägg: 4 okt 2023 17:27
Tänker du att nitrit har en "egen våglängd" av ljus som den kan absorbera?
Jag skrev ett test som skulle kunna användas för att bestämma koncentrationen, har du testat att söka lite om det?
Ja, Griess test. I stora drag att man tillsätter svavelsyra och en indikator och ser om det sker en färgförändring? Det var åtminstone det jag hittade på svenska resurser. Men just att använda spektrofotometer verkar mer lockande för det är ett verktyg jag redan är bekväm med.
Jo det är överlag så testet fungerar. Och testet används för att kvantitativt mäta koncentrationen av nitrit, med spektrofotometer.
Minns inte vilken av jonerna det är men en av dem borde gå att mäta direkt. Men det finns samtidigt massvis med andra ämnen i munnen, som också absorberar inom de våglängder du kan ha tillgång till att mäta vid med en spektrofotometer Uv-synligt ljus är ganska vanligt) - så absorbansen du mäter t.ex. vid våglängden 350 nm kommer inte endast från jonen, utan från andra ämnen. Men om du använder en kemisk reagens som Griess test, är färgförändringen proportionell mot mängden nitrit, och du kan mäta just färgförändringen. Du slipper på så vis även oönskade ospecifika bidrag till absorbansen från andra ämnen.
Ja okej, ja då förstår jag! Jag missförstod ditt förra inlägg som att du föreslog två separata metoder, men då förstår jag. Tack så hemskt mycket för förslagen! Jag ska diskutera detta med min biologilärare och återkomma senare.
Det är lätt att framställa nitrit om du vill testa de två metoderna. Hettar du upp lite (några korn) natriumnitrat i en degel över en brännare så sönderfaller det i natriumnitrit och syrgas.
Jag har talat med min biologilärare och han tyckte idén lät genomförbar! Tack så mycket för dina utförliga inlägg @mag1!
En fråga jag dock har är hur snabbt man skulle kunna mäta sådan här förändring? Alltså säg att två bakterieodlingar har funnits ungefär lika länge innan behandling av munvatten, då skulle nitrithalten vara ungefär samma i båda odlingarna, förutsätt att jag odlar samma mängd av samma bakterier. Säg att man sedan behandlar ett av proverna men inte det andra. Då skulle mängden nitrit i det obehandlade provet öka mer än vad den skulle göra i det behandlade provet, förutsatt att munvattnet faktiskt hämmar eller dödar bakterierna, visst är det så?
Så om jag skapar två odlingar samtidigt, behandlar den ena och inte den andra, och efter en viss tid mäter absorbansen efter tillsats av reagens, skulle jag kunna förvänta mig att de olika proverna absorberar olika mycket av ljuset?
Kul att höra att du går vidare med idén.
Ja du bör kunna mäta detta efter ganska kort tid. Saliven i munnen tar med sig ämnen från bakterierna hela tiden, och bakterierna bildar ämnen hela tiden. Så om du gör dina prover och behandlar det ena med munskölj bör du se en skillnad kanske redan efter en dag.
Du kan förvänta dig att både mängden munskölj och tiden påverkar bildningen av nitrit, men inte nödvändigtvis på samma sätt, så du behöver nog undersöka båda.
T.ex. högre koncentration munskölj borde ge en större effekt (minskning av nitrit), men för hög koncentration kanske dödar lite för mycket av bakterier.
Nitritbildningen sker nog hela tiden (under "rätt" förutsättningar, ganska lite syre etcetera), men i ditt experiment kanske det tar ett tag för bakterierna att bilda tillräckligt mycket nitrit så du kan mäta koncentrationen.
För att få jämförbarhet mellan proverna är det nog enklast att du skrapar ihop bakterier, blandar upp dem väl i lite odlingsmedia så att bakterierna är finfördelade i vätskan. Och så använder du denna vätska för att sedan tillsätta till dina provodlingar med/utan munskölj. Och så behöver du något annat att tillsätta istället för munskölj till kontrollproverna.
Enklaste är nog att testa några prover (utan munskölj) och låta dessa stå olika länge för att i ett förförsök undersöka hur lång tid det tar. T.ex. ett prov vid 0 h, sedan prover vid olika tidpunkter, 2, 4, 8, 12, 24, 36 ,48 timmar eller något liknande. Då kan du se hur lång tid det tar.
Gör du dessutom en serie med munskölj, ser du
Hej, tack för svar!
Jag håller i nuläget på att undersöka vad jag behöver och hur jag ska gå till väga. En sak som slog mig nu var att de bakterier som bildar nitrat-reduktas, som reducerar nitrat till nitrit, huvudsakligen gör detta under syrefattiga förhållanden. Men om jag odlar bakterierna i någon form av buljong, hur ska man få det syrefattigt? Det kommer väl alltid finnas syre löst i vätskan?
Och angående själva bakterieodlandet, så kommer jag ju få med många olika typer av bakterier i början. Dessa kommer ju konkurrera om resurser i lösningen, hur ser man då till att vissa arter inte bara konkurrerar bort andra? Jag vill ju att min odling ska likna floran i munnen så mycket som möjligt. Eller är det kanske bättre att först odla bakterierna i ett fast medium och sedan försöka separera dem till vätska, så att varje vätskeodling endast innehåller en typ av bakterie?
naytte skrev:Hej, tack för svar!
Jag håller i nuläget på att undersöka vad jag behöver och hur jag ska gå till väga. En sak som slog mig nu var att de bakterier som bildar nitrat-reduktas, som reducerar nitrat till nitrit, huvudsakligen gör detta under syrefattiga förhållanden. Men om jag odlar bakterierna i någon form av buljong, hur ska man få det syrefattigt? Det kommer väl alltid finnas syre löst i vätskan?
Jo det kommer finnas syre i vätskan, men samtidigt en syreförbrukning av de aeroba bakterierna. När aeroba bakterier odlas behöver odlingsmediet hela tiden skvalpas runt, så syre/koldioxid hela tiden byts ut, annars blir det för lite syre för de aeroba bakterierna.
Vid odling av anaeroba bakterier används ofta små påsar med oxidant i, som förbrukar det syre som finns, och plattor eller ventilerade rör läggs med oxidantpåsen i en annan påse som försluts så att inte mer syre kommer in från luften.
Alternativt kan du fylla rören så mycket det går, och försluta dem, så att så lite luft som möjligt finns med - och sedan hoppas att de aeroba bakterierna kommer oxidera bort syret. Men det tar då lite längre tid.
Som odlingsmedia kan du överväga något som mer liknar deras naturliga mat - d.v.s. det som finns i försökspersonens munhåla. Saliven med lite extra näring är vad bakterierna är vana vid att leva i och äta.
För att stimulera salivering används ofta paraffinkapslar, som när man tuggar på dem får saliven att flöda till, och saliven kan då spottas ut och samlas upp. Och om detta görs efter att försökspersonen ätit, finns det matrester kvar som kan följa med - d.v.s. vad bakterierna brukar äta. Kanske låter lite ofräscht, men det är precis vad vi alla sväljer i oss efter en måltid, men inget vi brukar samla upp utanför kroppen.
Och angående själva bakterieodlandet, så kommer jag ju få med många olika typer av bakterier i början. Dessa kommer ju konkurrera om resurser i lösningen, hur ser man då till att vissa arter inte bara konkurrerar bort andra? Jag vill ju att min odling ska likna floran i munnen så mycket som möjligt. Eller är det kanske bättre att först odla bakterierna i ett fast medium och sedan försöka separera dem till vätska, så att varje vätskeodling endast innehåller en typ av bakterie?
Separera bakterierna är knepigare, och inget som görs enkelt. Det ökar dessutom risken för att vissa mindre trevliga/skadliga bakterier får en chans att växa till sig mer än vad de skulle kunna i situationer med konkurrens.
Och som du skrev så motsvarar en "utvald typ av bakterie" inte floran. Det är dessutom så att hela floran påverkas av munsköljen, och de "överlevande bakterierna" är dessutom med och tar emot lite av ämnena från munsköljen, och skyddar på så vis de bakterier som tar stryk av munsköljen.
Men det är knepigt att få med bakterier från de mer anaeroba miljöerna i munnen utan t.ex. mellanrumsborste eller tandpetare. Vill du få med mer av bakterierna kanske du behöver kombinera saliv, skrapande (tunga/kinder) och mellanrumsborstande.
Oavsett hur du samlar in bakterier kommer de konkurrera under odlingen, men så länge du kan få ner syrehalten till noll eller nära noll, kommer de anaeroba bakterierna gynnas och må bra. De kommer dock, precis som i munnen, försöka ta överhanden - precis som alla andra, det är strid om resurserna och platsen.
Hej igen!
Jag har har diskuterat projektet med min handledare idag och preliminärt tänkte jag att följande upplägg kan vara en bra start:
- Skapa munsköljsliknande lösningar med olika substanser, till exempel klorhexidin, peroxid, klordioxid osv. Även lite svagare substanser.
- Svabba olika delar av munnen ordentligt (så att bakterierna man odlar upp blir representativa för floran i munhålan) och skrapa av dessa bakterier i en behållare med LB-medium eller annan näringslösning och blanda.
- Efter initial tillväxt hälla över en bestämd volym till olika behållare. För test av varje aktiv substans tänker jag att man kan ha två behållare. En där man inte gör något alls och en där man behandlar.
- Utföra behandlingarna med munsköljen och låta lösningarna stå kanske 16 h till, så att mer nitrit hinner bildas.
- Tillsätta Griess reagens (färdigt kit) och använda spektrofotometer för att mäta absorbansen hos azofärgmolekylerna som bildas. Tror att våglängden låg på ca. 540 nm eller liknande.
- Notera huruvida behandlade prover har lägre nitritkoncentrationer än icke-behandlade prover
Några problem då:
- Att få till en syrefattig miljö kan som sagt bli problematiskt. Men det kanske inte gör så mycket? Många delar av munnen är ju inte syrefattiga och nitratreduktionen sker väl där också? Eller är det kartlagt var i munnen det sker?
- Hur länge skulle proverna behöva stå innan man kan mäta nitritkoncentrationer? I de flesta kitten står det att nitritkoncentrationerna ska ligga kring 1 μM - 100 μM för att testet ska ge ordentliga resultat. Hur länge kan man förvänta sig att bakterierna ska behöva stå innan man uppnår sådana koncentrationer?
- Är det möjligt att något annat än spektrofotometer, Griess reagens och mina lösningar behövs för att göra mätningarna?
Svårt att svara på om syrekoncentrationen verkligen måste vara låg för att få nitritbildning, det kanske bildas vi ganska låga koncentrationer? Men det är nog en bra idé att skapa en syrefri miljö, för att stimulera bildandet av nitrit (och inte oxidera m.h.a. syre).
Någon borde ha kartlagt var de nitritbildande anaeroba bakterierna finns i munhålan, men det kanske kräver en del letande/läsande för att skapa sig en uppfattning om detta.
Syrefattiga miljön kan du skapa i en tät plastpåse/låda med t.ex. handvärmare av engångsbruk som finns att köpa i friluftsbutiker, Clas Ohlson eller liknande. Dessa påsar innehåller järn som oxideras av luftens syre och värme bildas. På så vis förbrukas syret inuti påsen/lådan, och när syret är slut i påsen avstannar reaktionen av sig själv. Om inte lådan är för stor/otät misstänker jag att en påse räcker till att förbruka ganska mycket syre - men jag skulle råda dig att räkna på detta som en del av "förberedelserna" i Gy-arbetet.
Värmen kan vara ett problem för bakterierna, som inte gillar höga temperaturer. Men tar du en genomskinlig påse/låda och en liten termometer, kan du få reda på hur varmt det blir, och vid behov kompensera för värmebildningen genom att ställa lådan utomhus eller lägga is(vatten) runt lådan för att kyla.
Hur lång tid det tar för att bilda nitritkoncentrationer höga nog att mäta på, beror till stor del på hur du designar ditt experiment. Ett sätt kan vara att göra ett preliminärt experiment där du undersöker bl.a. hur lång tid du behöver låta bakterieodlingarna stå.
Om du använder en spektrofotometer kan du även mäta koncentrationen av bakterier generellt i vätskan, vid 280 nm. På så vis kan du korrelera mängden bildad nitrit till antalet bakterier, för att undersöka om/hur antalet bakterier påverkar mängden bildad nitrit. Risken finns annars att en odling där bakterierna generellt inte växer så bra får en låg nitritkoncentration - d.v.s. alla bakterier växer inte bra. Jämfört med ett scenario där nitritbildande bakterier dör, medans de andra växer på. Båda dessa kan ge samma nitritkoncentration men p.g.a. två olika orsaker.
För punkt 3. - Om du tillsätter de munsköljsliknande ämnena till bakterieodlingarna, blir det nog en ganska hård behandling av alla bakterier, då bakterierna exponeras under hela tiden. Detta jämfört med att en munsköljsanvändare använder lösningarna en kanske 30 sekunder och sedan spottar ut vätskan. Dosen som bakterierna utsätts för, och tiden blir m.a.o. mycket längre.
Tack för det (som vanligt) utförliga svaret!
Jag ska utföra en del slasktester kommande veckor för att se hur experimentet kan designas på bästa sätt.
Tack för tipset med hur jag kan åstadkomma en syrefattig miljö! Jag ska testa detta!
Angående att mäta antalet bakterier, menar du då att jag på något sätt skulle kunna bestämma bakteriekoncentrationen absolut eller snarare att korrelera absorptionen hos bakterierna med absorptionen när jag kvantifierar mängden nitrit?
Angående punkt 3:
Visst är det så att ett agarmedium stelnar vid tillräckligt låga temperaturer? Man skulle kanske tillsätta agar till bakterieodlingarna och sedan skölja med de aktiva substanserna och sedan torka bort dem eller spola av dem? Eller är det så att bakterierna hamnar i agaren och inte "ovanpå"?
Alternativt skulle man kanske kunna använda välidgt låga koncentrationer aktiv substans? Alltså helt enkelt späda ut lösningarna ganska mycket. Då skulle exponeringen minska.
naytte skrev:Tack för det (som vanligt) utförliga svaret!
Jag ska utföra en del slasktester kommande veckor för att se hur experimentet kan designas på bästa sätt.
Tack för tipset med hur jag kan åstadkomma en syrefattig miljö! Jag ska testa detta!
Angående att mäta antalet bakterier, menar du då att jag på något sätt skulle kunna bestämma bakteriekoncentrationen absolut eller snarare att korrelera absorptionen hos bakterierna med absorptionen när jag kvantifierar mängden nitrit?
Eftersom du planerar att utföra experimentet i en vätska, kan du bestämma den absoluta bakteriekoncentrationen (i arbitrary units, AU). På så vis vet du hur många bakterier det finns i respektive bakterieodling - och du kan då korrelera mängden nitrit till detta. På så vis kan du få en uppfattning om hur jämförbara dina nitritvärden är
T.ex. ett scenario med olika prover:
1) med hämmande ämne: 0,5 AU bakterier, 45 enheter av nitrit
2) utan hämmande ämne: 3 AU bakterier, 400 enheter av nitrit
eller
3) med hämmare: 0,1 AU bakterier, 9 enheter av nitrit
Om du "bara" tittar på nitritmängderna är det en stor skillnad vid jämförelse med 2) för proverna 1 och 3, men det är precis samma ratio bakterie/nitrat för båda proverna. Så det kanske är mer relevant att jämföra ratio mellan de tre proverna. (Och det beror på hur du tolkar resultaten i sammanhanget).
Angående punkt 3:
Visst är det så att ett agarmedium stelnar vid tillräckligt låga temperaturer? Man skulle kanske tillsätta agar till bakterieodlingarna och sedan skölja med de aktiva substanserna och sedan torka bort dem eller spola av dem? Eller är det så att bakterierna hamnar i agaren och inte "ovanpå"?
Ja det stämmer att det stelnar vid lägre temperaturer. Men bakterierna gillar inte temperaturer över 37°C, och du vill kanske vilja odla vid denna temperatur? För är det för varmt dör bakterierna av hettan. Det blir även knepigare att lösa upp agar för att sedan mäta koncentrationerna med spektrofotometer.
Alternativt skulle man kanske kunna använda välidgt låga koncentrationer aktiv substans? Alltså helt enkelt späda ut lösningarna ganska mycket. Då skulle exponeringen minska.
Ja det kan nog vara enklare rent praktiskt. Kanske en spädningsserie, med olika koncentrationer av ämnena kan vara ett sätt att hitta en lämplig koncentration?
Det blir dock fler prover att arbeta med och analysera.
Hej igen!
Jag kollade nyligen på en video angående bakterieinkubation och för att simulea anaeroba förhållanden tillsatte kvinnan i videon lite flytande paraffin, ett ämne som inte släpper igenom syre. Detta ämne löste sig inte heller i näringsbuljongen utan lade sig ovanpå. Kanske skulle även jag kunna göra något liknande för att få till den syrefattiga miljön? Det enda syret som skulle finnas i min lösning skulle vara syret som är löst i näringsmediet.
Ja flytande paraffin skulle fungera som "lock". Det finns att köpa på apotek. Det behöver inte vara just paraffinolja, det är en produkt som är renare än annan paraffinolja (som du hittar i färghandeln).
I princip skulle vanlig matolja fungera det med, de enda riskerna med matolja är att den även kan innehålla andra biologiska ämnen som kan påverka bakterierna, samt att bakterierna kan börja leva delvis av oljan (men med begränsad syretillgång, och nitrat kommer deras metabolism nog inte kunna oxidera så mycket av matfetterna).
Fördelen med en vätska som barriär mot atmosfären är att du kan sticka ner en pipett genom oljan, och ta ett prov av, den från atmosfären skyddade vätskan, under oljan. Kanske mest användbart under ett längre experiment (där man kanske vill ha mätvärden från flera olika tidpunkter).
Tack för så snabbt svar!
Ännu en grej: jag kommer försöka ställa upp en standardnitritkurva för att slippa använda godtyckliga enheter och istället använda SI-enheter. I idealfallet skulle jag redan haft en färdig nitritlösning med känd nitritkoncentration men jag tänker att jag får improvisera lite istället. Jag tänker mig följande förfarande:
- Smälta kaliumnitrat så att det sönderfaller till kaliumnitrit och räkna på utbytet
- Lösa en känd mängd av kaliumnitritet i en känd volym vatten så att man får en känd koncentration nitrit
- Tillsätta Griess reagent och mäta absorbansen med spektrofotometer
- Förändra koncentrationen nitrit och göra samma sak igen
- Korrelera absorbansen till kända nitritmängder
Om jag gör det på det här sättet tänkte jag att jag kan "placera in" mina uppmätta absorbanser senare när jag gör mina riktiga experiment. Så om jag visste utifrån min standardkurva att en absorbans på motsvarar M nitrit kan jag på så sätt bestämma mina nitritkoncentrationer i bakterielösningarna. Hur låter det?
Sedan kommer vi ju till ett annat problem: hur ska jag kvantifiera antalet bakterier i mina prover? Jag tänkte att man kan bestråla dem med ljus på 600 nm med spektrofotometer och använda Beer-Lamberts lag för att plocka fram ett samband dC/dt. Vad tror du om det? Då skulle jag ju för varje ny odling alltid kunna förutsäga ungefär hur stor koncentration bakterier det rör sig om, så länge ursprungsförhållandena är samma (svabbar samma ställen, samma mängd syre, näring osv).
Enklaste vore nog att använda ett rent nitritsalt, t.ex. natriumnitrit, då kan du direkt jämföra. Men detta beror på om ni har detta salt, eller det finns pengar att köpa in det till skolans kemikaliesamling. Detta salt används som livsmedelstillskott och kallas E250. Det finns att köpa som konserveringsmedel för t.ex. fisk och korv, men exakt hur rent saltet är i dessa produkter låter jag vara osagt.
Din idé om att låta nitrat sönderfalla till nitrit borde fungera. Det är förresten ett sätt att frisätta/bilda syrgas, som kan används som reagens etcetera inom kemin. Och efter att ha blandat en lösning med känd koncentration, behöver du bara skapa en spädningsserie, och från detta data går det att skapa den standardkurva med Abs-koncentrationssambandet, som du skrev om. Du bör dock göra kontroller för att utesluta att någon annan faktor påverkar, t.ex. att något i odlingsmediet påverkar absorbansen (odlingsmediet skiljer sig ju en del från vatten).
Koncentrationen av bakterier i vätskan går bra att mäta vid 600nm, det är brukligt vid odling av bl.a. E. coli, men det förutsätter att din lösning är helt homogen (d.v.s. du behöver se till att bakterierna finns jämt fördelade i vätskan som du tar provet ifrån, men det kan du se till m.h.a. en pipett), för bakterierna har en tendens att sedimentera (sjunka till botten). Kom bara ihåg att använda odlingsmedia som ditt blankprov, innan du mäter absorbansen av bakterieprovet (mediet skiljer sig som sagt en del kemiskt/optiskt från vatten).
Det rent praktiskt enklaste är nog att först skapa standardkurvan, samtidigt som du kontrollerar att Gries test inte påverkas av t.ex. odlingsmediet. Sedan kan du i princip skapa en och samma provvätska, och späda ut den i flera rör (där tillsatserna finns) och sedan låta dem stå och mogna alla parallellt - då slipper du behöva jämföra data mellan olika experimentserier/dagar, utan kan istället (om du varit noggrann) göra antagandet att allt startmaterial med bakterier som du tillsätter till rören är lika. Och i idealfallet bör du ha flera lika dana prover (t.ex. triplikat , för att se att det inte blir några systematiska eller stokastiska fel under experimentet. Antalet rör blir dock snabbt stort med triplikatprover, men det får du en känsla för när du planerar experimenten.
Det kan ju bli så att det är just de nitritanvändande bakterierna som dör (då minskar nitriten, och kanske även bakteriernas koncentration), så det kanske blir lite att klura hur resultaten kan förklaras, men det får du ta när det kommer :)
Men med data om bakteriernas tillväxt, mängden nitrit, tror jag det finns goda möjligheter att se om/hur bakterierna påverkas av de tillsatser du utsätter dem för.
Hur har du tänkt att döda av bakterierna efter experimenten? Du kommer nog att odla en del bakterier som kan vara otrevliga/skadliga, t.ex. Streptokocker. Vid odling av bakterier inom klinik och forskning, finns det rutiner för att avdöda bakterier (och andra saker som kan finnas i kroppsvätskor), innan "avfallet" kasseras. Har skolan tillgång till en autoklav, eller kemiska inaktivering som du kan använda?
Koncentrationen av bakterier i vätskan går bra att mäta vid 600nm, det är brukligt vid odling av bl.a. E. coli, men det förutsätter att din lösning är helt homogen (d.v.s. du behöver se till att bakterierna finns jämt fördelade i vätskan som du tar provet ifrån, men det kan du se till m.h.a. en pipett), för bakterierna har en tendens att sedimentera (sjunka till botten).
Skulle jag bara kunna röra runt då för att se till att fördelning blir så jämn som möjligt eller hur kan jag åstadkomma det?
Och en fråga angående Beer Lamberts lag. Sambandet jag hade tänkt använda är , men problemet är att jag ju inte vet något om hur väl min "bakteriemix" kommer kunna absorbera ljuset. Normalt sett har man ju en absorptionskonstant för en bestämd species man jobbar med, men jag jobbar ju med flera species samtidigt. Så antingen får jag försöka plocka fram ett värde på absorptionskonstanten själv eller så kanske jag kan gå på något typ av genomsnitt för baktierer? Om det finns?
Har skolan tillgång till en autoklav, eller kemiska inaktivering som du kan använda?
Japp, vi har autoklav.
Du kommer få ett absorbansvärde från spektrofotometern i med enheten "arbitrary units" (alla de andra enheterna förkortas bort enligt Labmert-Beers lag). Och med detta värde kan nu relatera koncentrationen av bakterier mellan proverna, och normalisera nitritvärdena. Du behöver inte veta hur många bakterier det är, utan endast hur stor (koncentrations)skillnaden är mellan proverna. Det behövs helt andra metoder för att kunna kvantifiera antalet bakterier.
Du kan t.ex. samla in absorbansvärden:
1) vid 600nm, som innehåller information om antalet celler, och om du tar dessa vid flera tidpunkter kan du få reda på om/hur snabbt bakterierna växer över tiden (tillväxthastigheten m.a.o.).
2) m.h.a. Griess test vid samma tidpunkter, får du reda på koncentrationen av nitrit.
Och genom att kombinera 1) och 2), kan du få reda på mängden nitrit per mängd celler, och om du vill t.o.m. över tiden, vilket blir ett relativt mått. Detta relativa mått innehåller informationen om bakteriernas relativa koncentration, utan att du behöver bestämma deras precisa antal.
Jag tror jag förstår vad du menar.
För åskådliggörandets skull skulle man alltså kanske kunna göra en 3D-plot á la:
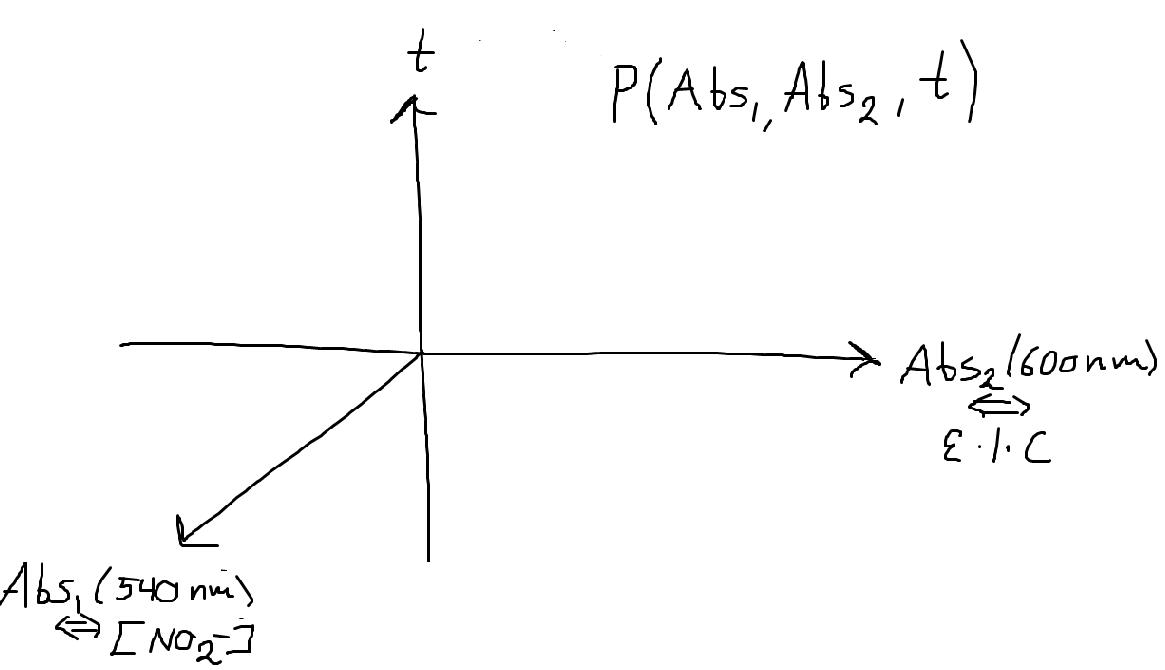
Och undersöka hur placeringen av varje punkt i xy-planet förändras med/utan behandling. Eftersom absorptionskonstanten är ungefär samma hela tiden är det bara intressant hur odlingarna förhåller sig till varandra. Är det typ det du menar?
Och om jag har lagt i en viss mängd Griess reagens vid sig t=x och mätt en viss absorbans vid 540 nm, kommer jag behöva tillsätta mer Griess reagens senare vid t=y när jag mäter absorbansen vid 540 nm igen, eller kommer "överskottet" från första mättillfället användas istället? Jag tänker att mängden azofärg ökar med tiden, så länge jag tillsatte en tillräckligt stor mängd av reagenset vid första mättillfället.
Tillägg: 14 jan 2024 11:32
Glöm det sista stycket om Griess reagens. Vet inte vad jag tänkte där.
Du behöver inte använda tre dimensioner (om du inte vill/känner att det gör det enklare att presentera/analysera ditt data).
Ofta används kombinationer av mätserier i ett och samma 2D diagram, eller flera 2D diagram eller t.o.m en tabell kan räcka (illustrationer underlättar för läsaren dock). Där du kan plotta respektive mätseries värden, tillsammans med t.ex. celldensitetsnormaliserade värden för nitrit liknande i den (endast illustrativa) bilden nedan, med celltillväxten till vänster, nitrithalten bredvid, bägge serierna, och sedan det normaliserade datat(Abs. 540/600 per mätpunkt).

Nu vet du inte hur datat kommer se ut, men om nitrithaltens koncentration förändras annorlunda än cellernas tillväxt, så kommer tolkningen av resultaten att bli olika. Jämför t.ex. bilden näst längst till vänster med den högra - det blir i exemplet en stor skillnad i hur man kan tolka nitritkoncentrationen, efter att hänsyn tas till cellernas tillväxt).
Det behöver inte vara en skillnad, de kan följa varandra 1:1, men det kan finnas en annorlunda korrelation än 1:1. Det var därför jag föreslog att också titta på hur snabbt/mycket cellerna växer. T.ex. om alla celler dör (det var rent giftigt med en tillsats) kanske inte nitrithalten minskar alls, eller helt och hållet för det sker en massa icke-biologiska redoxreaktioner.
Kanske en fråga som tyder på stor okunskap, men vad innebär det att datan är normaliserad?
Och i kurvan längst till höger med den cellantalsrelativa mängden nitrit, är det som att man tar varje mätpunkt i diagrammet till vänster, t.ex. en punkt (Abs1, Abs2) och delar de på varandra? För att visa på de relativa förhållandena bakterier/nitrit? För att man annars löper risk att nitritkonc. minskar pga att bakterierna minskar i allmänhet?
naytte skrev:Kanske en fråga som tyder på stor okunskap, men vad innebär det att datan är normaliserad?
Nej det är inte okunskap, bara att du kanske inte kommit i kontakt med det ännu. Det går att normalisera data mot t.ex. ett bakgrundsvärde - t.ex. genom att absorbandsvärdet för bakgrunden subtraheras från mätvärdet. Det kan användas om bakgrundsvärdena inte är noll, men inte heller så höga att mätvärdet bara är brus/bakgrund. Om bakgrundsvärdena ökar lite över tiden (t.ex. +1 per timme), men mätvärdena mycket (t.ex, +5 per timme) så kan resultatet över tiden presenteras normaliserat - där bakgrunden för varje mätpunkt subtraheras från mätvärdet. Det är ett sätt att presentera resultatet, där trenden kan visas mer lättolkat, men man måste så klart ange att och hur datat är normaliserat.
Och i kurvan längst till höger med den cellantalsrelativa mängden nitrit, är det som att man tar varje mätpunkt i diagrammet till vänster, t.ex. en punkt (Abs1, Abs2) och delar de på varandra? För att visa på de relativa förhållandena bakterier/nitrit? För att man annars löper risk att nitritkonc. minskar pga att bakterierna minskar i allmänhet?
Ja precis, det är den relativa koncentrationen av nitrit. Och den får du genom att abs 1 (540 nm, d.v.s. nitritvärdena) delas med abs 2 (600nm, d.v.s. koncentrationen av celler).
Och som du listat ut, så kan risken för en till parameter (cellernas ökande antal) påverkar resultattolkningen minskas. För i exemplet så ökar nitritkoncentrationen i princip exponentiellt fram tills den sedan dyker ner, men mycket av detta kan förklaras genom att antalet celler samtidigt ökar. De röda linjerna kan t.ex. vara med munvatten tillsatt, och blå utan.
Tillägg: 15 jan 2024 09:55
Kom på en sak till, för förståelsen och inte nödvändigtvis för att du kommer behöva göra det, jag misstänker att det inte behövs men eftersom jag började prata om normalisering.
Normalisering används oftare mellan olika datamängder, t.ex. om du först gör hela ditt experiment dag 1 och sedan repeterar hela serien, eller gör en uppföljning dag 3 (t.ex. med ett nytt preparat av munskölj). För att ha en möjlighet att kombinera resultaten mellan dag 1 med resultaten för dag 3, kan resultaten normaliseras med varandra.
T.ex. att ett värde från dag 1 (t.ex. 25 µM) normaliseras med sin positiva kontroll (1 µM) och då får ett värde av 25 µM. Sedan vill du jämföra det nya värdet (75µM) från dag 3, med resultat från dag 1. Och genom att normalisera värdet från dag 3 med sin egna kontroll (1,5 µM), får du normaliserade värden mellan resultaten från dagarna, som är jämförbara. Så 25µM från dag 1, är då normaliserat/på samma skala som (75/1,5) 50µM från dag 3.
Är bakgrunden dag 3 istället fortfarande 1µM, blir jämförvärdet så klart högre.




