Isomeri hos cyklisk hemiacetal
Hej,
Uppgiften ser ut så här och jag har inte problem med deluppgift a. Jag lyckas rita upp mekanismen för bildandet av hemiacetalen, men har verkligen svårt att bygga molekylen och få rätt stereokemi. Jag har förstått att OH-gruppen måste vara riktad uppåt och att attacken på karbonylkolet kan ske från både sidorna (vilket resulterar i en racemisk blandning) men jag vet inte riktigt hur den informationen kan hjälpa mig och syret ändå komme vara inklämt mellan två kol (se skärmbild 2). Om vi frånser molekylbyggsatsen så finns det ju två grupper på kol 5 som ''direkt'' påverkas av OH-gruppens stereokemi: vätet och alkylgruppen. Hur vet man att alkylgruppen hamnar neråt i samtliga stereoisomerer om OH-gruppen hamnar uppåt? Varför gör inte vätet det? Om jag bara får svar på den frågan kan jag ju alltid göra en ''ring flip'' av den stereisomeri som är rätt.
.jpg?width=800&upscale=false)
-(2).jpg?width=800&upscale=false)
Tacksam för hjälp!
Hydroxisyret på kol 5 i 5-hydroxietanalen blir ju det som (jag tror) du menar med "inklämt" i ringen efter cykliseringen. Den nya hydroxigruppen på kol 5, efter cykliseringen, hamnar antingen under eller över ringens tänkta plan, därav R/S, precis som du skrev. Men stereokemin för hydroxi- och metylgruppen på kol5 i 5-hydroyetanalen är definitiv innan reaktionen (vätet pekar ner, hydroxigruppen upp). Och det sker ingen omlagring av dessa bindningar alls under cykliseringen. Så det stereokemiska förhållandet mellan vätet och syret är oförändrat efter ringslutningen, med den ena upp och den andra ner. Om du följer bindningarna från ringsyret till kol fem, vidare till kol 4 så är denna del av molekylen identisk i R/S formen.
Du kan istället betrakta det som att det är substituenterna på kol 5 i hemiacetalen, som påverkar stereoisomerin för hydroxigruppen på kol 1.
mag1 skrev:Hydroxisyret på kol 5 i 5-hydroxietanalen blir ju det som (jag tror) du menar med "inklämt" i ringen efter cykliseringen. Den nya hydroxigruppen på kol 5, efter cykliseringen, hamnar antingen under eller över ringens tänkta plan, därav R/S, precis som du skrev. Men stereokemin för hydroxi- och metylgruppen på kol5 i 5-hydroyetanalen är definitiv innan reaktionen (vätet pekar ner, hydroxigruppen upp). Och det sker ingen omlagring av dessa bindningar alls under cykliseringen. Så det stereokemiska förhållandet mellan vätet och syret är oförändrat efter ringslutningen, med den ena upp och den andra ner. Om du följer bindningarna från ringsyret till kol fem, vidare till kol 4 så är denna del av molekylen identisk i R/S formen.
Du kan istället betrakta det som att det är substituenterna på kol 5 i hemiacetalen, som påverkar stereoisomerin för hydroxigruppen på kol 1.
Okej, tack! Jag kanske ska förtydliga att det är vätet på kol 3 i cyklopentanen som jag pratar om. Att vätet på kol 5 i aldehyden (kol 2 i cyklopentanten) alltid hamar under OH-gruppen är jag med på, men hur vet man hur det blir med alkylgruppen och vätet på kol 3 i cyklopentan? Måste man använda en molekylbyggsats för att se det, eller kan man tänka att alkylgruppen (svansen i aldehyden) indirekt påverkas av OH-gruppens stereokemi?
Hoppas inte min fråga är alltför rörig!
Det känns som vi pratar förbi varandra. pg.a. numreringen i den bildade tetrahetrahydropyranringen. Den borde vara som i bilden nedan, för 5-metyloxan-2-ol.
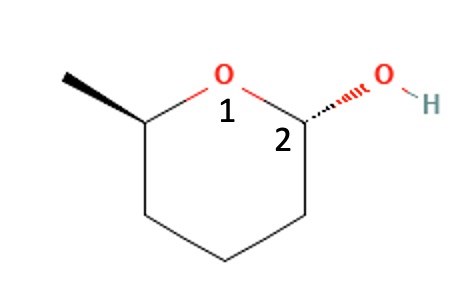
Insåg att jag i så fall numrerat fel i mitt svar, så det blev inte riktigt klart och enkelt att beskriva. Men om vi utgår ifrån numreringen i bilden, så blir det enklare att prata.
mag1 skrev:Det känns som vi pratar förbi varandra. pg.a. numreringen i den bildade tetrahetrahydropyranringen. Den borde vara som i bilden nedan, för 5-metyloxan-2-ol.
Insåg att jag i så fall numrerat fel i mitt svar, så det blev inte riktigt klart och enkelt att beskriva. Men om vi utgår ifrån numreringen i bilden, så blir det enklare att prata.
Okej, bra! Så min fråga är då egentligen hur man kan determinera stereokemin på alkylgruppen och vätet. Kan man göra det bara genom att utgå från OH-gruppens sterokemi i aldehyden?
Det är ju ett eget kiralt center vid kol 6, som avgörs av substituententerna på kol 6 (de två olika "hållen" längs ringen (1,2,3.. och 5,4,3 utgör varsin "substituent"). Detta stereocenter kol6 är lika (R) i båda formerna av ämnen så det bidrar till stereokemin för hela molekylen, men eftersom denna kiralitet är oförändrad från startmaterialet så avgör stereocentret på kol 2 vilken kiralitet som produkten får.
Vill då få (S) isomeren på kol 6 i produkten (2S, 6S eller 2R,6S), behöver du börja med S-enantiomern av 5-hydroxyetanalen.
mag1 skrev:Det är ju ett eget kiralt center vid kol 6, som avgörs av substituententerna på kol 6 (de två olika "hållen" längs ringen (1,2,3.. och 5,4,3 utgör varsin "substituent"). Detta stereocenter kol6 är lika (R) i båda formerna av ämnen så det bidrar till stereokemin för hela molekylen, men eftersom denna kiralitet är oförändrad från startmaterialet så avgör stereocentret på kol 2 vilken kiralitet som produkten får.
Vill då få (S) isomeren på kol 6 i produkten (2S, 6S eller 2R,6S), behöver du börja med S-enantiomern av 5-hydroxyetanalen.
Aha, jag missade totalt att vätet i kol 5 på aldehyden är det som hamnar neråt på samma kolatom som alkylgruppen i hemiacetalen. Det förklarar ju varför den riktar nedåt på både isomerer.
Tack för hjälpen!

