Jämna ut laddningar
Hej!

I uppgiften ovan har guldet oxiderats 3 steg, och kvävet har reducerats 3 steg (facit). Nu som sista steg ska man balansera laddningarna med hjälp av "H3O^+", och detta har jag svårt med.
Jag ser att laddningarna (innan man skriver till H3O^+ samt H2O) är VL=-2 och HL=-1.
Jag förstår inte riktigt hur man ska tänka härifrån för att lösa uppgiften?
Tack på förhand!
Jag har skrivit ett långt inlägg om hur man balanserar den här typen av reaktioner. Börjar med att läsa det och se ifall du tar dig vidare på egen hand utifrån det:
OK, tack! :)
Hej,
Jag har läst nu men känner fortfarande osäkerhet övet hur man bör balansera med H^+. Visst lägger man till 1 st H+ för varje minussteg som ska jämnas ut? Men det här med att försöka jämna ut med en hel H2O molekyl istället då? :(
Visa hur du har försökt!
Teraeagle skrev:Visa hur du har försökt!
Har jag tänkt rätt här? :
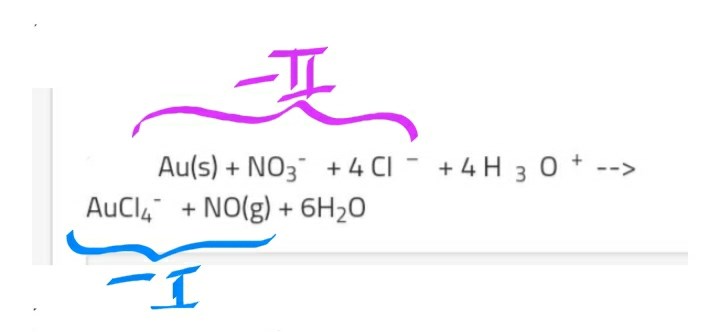
Kolla om syret stämmer: 3+4 = 7 syre före reaktionen, 1+6 = 7 syre efter reaktionen. Det ser alltså bra ut.
Tack Smaragdalena!




