Kan man tänka så här för Lewisstrukturer och FL?
Halloj!
Jag håller på att plugga inför en munta i kemisk bindning och läser på om Lewisstrukturer och formell laddning, specifikt hur man kan använda formell laddning för att bestämma den bästa lewisstrukturen. Jag har en fråga om ett generellt tankesätt. Kan man tänka att den bästa lewisstrukturen är den, där summan av beloppen av de formella laddningarna är minimal? T.ex. i SO2 finns det ju två möjliga Lewisstrukturer:
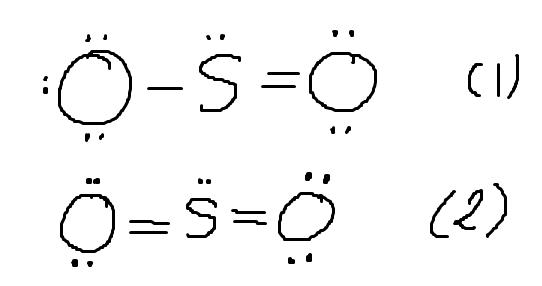
Hör ser vi att summorna blir:
∑FL1=|-1|+|1|+0=2
∑FL2=0+0+0=0
Så då skulle den andra strukturen vara den bästa.
Sedan undrar jag också hur man ska tänka om det finns flera Lewisstrukturer som båda har "samma summa". Måste man göra en djupare analys då för att avgöra vilken som är bäst?
Ja regeln är att minimera formell laddning. I praktiken finns det resonans mellan alla strukturer men den dominerande strukturen är den utan, eller med lägst formell laddning. I ditt exempel är det lätt att ta bort formell laddning genom att ge svavel en expanderad oktett, men det kräver att ämnet har tillgång till d-orbitaler. Kollar du t.ex. på kvävet i nitrat så är det inte möjligt.
Ja okej, det är rimligt. Är det det man brukar kalla för "expanded octet" på engelska?
Rimligtvis borde det väl vara så att alla grundämnen från och med rad 2 efter s-blocket i periodiska systemet har en "expanded octet"?
Jo så är det
Men när du säger att ämnet har tillgång till en d-orbital, visst menar du då att det finns en d-orbital (kanske tom) i valensskalet? För t.ex. svavel har ju inga valenselektroner i någon d-orbital i sig, men om man tryckte in fler elektroner i svavels valensskal skulle de ju hamna i en d-orbital.
Ja precis. Egentligen har ju alla ämnen möjlighet att binda via d-orbitaler men i period 1-2 ligger dessa så mycket högre i energi jämfört med valenselektronerna. Dvs 3d har mycket högre energi än 2p jmf med 3d vs 3p.
Men låt säga att vi kollar på en mer komplicerad molekyl som lustgas. Då gör ju kvävet fyra bindningar istället för tre (som vore antalet bindningar enligt oktetregeln). Vad händer där? Börjar kvävet fylla sin 3s-orbital då?
Hur menar du?
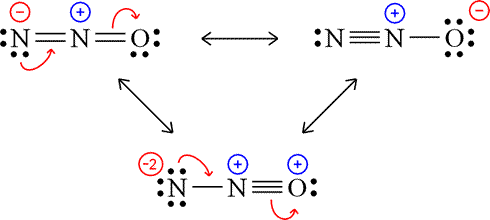
Oj, ja nu när jag räknar har ju båda kvävena åtta elektroner runt sig. Jag tänkte fel.



