Kemisk jämvikt kalkning

Hur ska jag veta hur formeln skrivs, och alltså vad som bildas?
Jag vet ju vilka som är reaktanter, men produkterna?
i a, hur ska jag veta att båda väteatomerna avges, är inte det en flerprotonig bas?
och i b, hur ska jag veta att det bildas koldioxid?
a) Den släckta kalken avger inga protoner alls - den löser upp sig till kalciumjojner och hydroxidjoner, och hydroxidjonerna reagerar med oxoniumjonerna i det sura sjövattnet
b) Det är sådant man behöver lära sig när man läser kemi. Att koldioxid och vatten blir till kolsyra och att kolsyra protolyseras i två steg är sådant du skall komma ihåg från Ke1.
borde man inte då kunna bortse från kalciumjonerna? Också borde det skrivas som vattnets autoprotolys.
och i b, menar du att det först bildas kolsyra? eller det går ju inte. Är kalciumjonerna starkare bas än kolsyra? Det låter inte rimligt.
Börja med att skriva hur du tycker att formlerna skall skrivas, så är det mycket lättare att hjälpa dig. Nu får jag sitta och försöka gissa hur du har skrivit med ledning av det diu skriver i ditt inlägg, och det är inte lätt!
a) Första steget är att det fasta saltet kalciumhydroxid löser upp sig till kalciumjoner och hydroxidjoner. Nästa steg är att hydroxidjonerna reagerar med oxiniumjoner från den försurade sjön (och då skall åskådarjoner som kalciumjonerna inte vara med).
Också borde det skrivas som vattnets autoprotolys.
Vad menar du med detta? Om du menar att neutralisationen är samma reaktion som vattents autoprotolys fast baklänges, så håller jag med dig.
b)
menar du att det först bildas kolsyra? eller det går ju inte. Är kalciumjonerna starkare bas än kolsyra? Det låter inte rimligt.
Kalciumkarbonatet reagerar med två oxoniumjoner så att det bildas kolsyra, som sönderfaller till koldioxid och vatten. Kalciumjonerna hamnar i vattenlösningen. Hur ser reaktionsformlerna ut?
Okej jag förstår.
Ja jag menar vattnets autoprotolys fast baklänges, se nedan hur jag tänkte. Förlåt att jag var lite otydlig.
I b tänkte jag först att det borde ske samma sak som i a, fast då att kalciumkarbonatet skulle läsa upp sig först, alltså skulle kalciumkarbonatet först bilda kalciumjoner och karbonatjoner och därefter skulle karbonatjonerna reagera med oxoniumjonerna och bilda kolsyra. Men detta tror jag är fel.
Sönderfaller alltid kolsyra till vatten och koldioxid?
Nedan är min lösning:
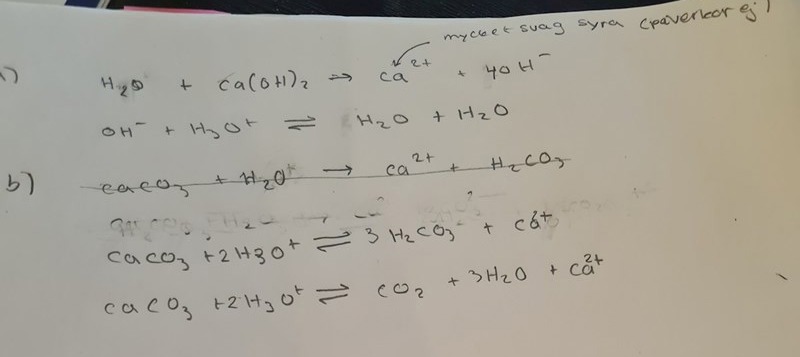
a) Vattnet är inte en reaktant i det första steget, det är bara en upplösning. Sätt ut (s) och (aq) på lämpliga ställen.
På b) skulle jag egentligen helst skriva reaktionen steg för steg, det känns mer troligt att det bara är karbonatjonerna som protoolyseras, inte vätekarbonatjonerna - om inte sjön är alldeles förfärligt sur. Förra gången jag skrev tänkte jag på "frästestet" man gör för att kolla om ett salt innehåller karbonatjoner, men det borde inte kunna finnas SÅ sura sjöar!



