Låter detta rimligt? Laboration.
Har en laboration där jag titrerar svag och stark syra,
HAc och HCl titreras med NaOH, båda syrorna är 0,1 M och NaOH är 0,100 M. V för syrorna är 20 ml medan V för NaOH är okänt. Vid ekvivalenspunkten var V för NaOh 19,5ml
"
Vid avläsning av grafen ger ekvivalenspunkten V = 19,5 ml = 0,0195 dm^3 för båda reaktionerna.
Halvtiterpunkten ger därför 9,75 ml = 0,00975 dm^3
Koncentrationen för HCl:
n (NaOH) = c(NaOH) * V (NaOH) = 0,100 mol/dm^3 * 0,0195 dm^3 = 0,00195 mol.
Molförhållandet är 1:1.
n NaOH = n HCl
C(HCl) = n(HCl) / V (HCl) = 0,00195 / 0,0200 dm^3 = 0,0975M
Svar: C(HCl) 0,0975M
Koncentrationen för HAc
n (NaOH) = c(NaOH) * V (NaOH) = 0,100 mol/dm^3 * 0,0195 dm^3 = 0,00195 mol.
Molförhållandet är 1:1.
n NaOH = n HAc
C(HAc) = n/v = 0,00195 * 0,0200dm^3 = 0,0975M
Syrakonstanten för HCl + NaOH
Ka = [H+] * [Cl-] / [HCl]
Vid halvtiterpunkter är [Cl-] = [HCl]
Ka = [H+]
pH vid halvtiterpunkten = 2,7
[H+] = 10^-2,7 = 0,0019952623 M
Ka = 0,0019952623 M
pKa = 2,7
Syrakonstanten för HAc + NaOH
Ka = [H+] * [Ac-] / [HAc]
Vid halvtiterpunkten [Ac-] = [HAc]
Ka = [H+]
pH vid halvtiterpunkten = 5,6
[H+] = 10^-5,6
Ka = 2,5 * 10^6
pKa = 5,6"
låter detta rimligt? Eller har jag gjort något felsteg
Du har missat att HCl är en stark syra, så den har inte något pKa-värde. Syrakonstanter gäller för en SYRA, inte för NaOH.
Smaragdalena skrev:Du har missat att HCl är en stark syra, så den har inte något pKa-värde. Syrakonstanter gäller för en SYRA, inte för NaOH.
Stämmer pKa-värdet för ättiksyran annars?
Varför har den inte det? Då antar jag att den inte heller har något Ka värde, eller?
plzhelpmath skrev:Smaragdalena skrev:Du har missat att HCl är en stark syra, så den har inte något pKa-värde. Syrakonstanter gäller för en SYRA, inte för NaOH.
Stämmer pKa-värdet för ättiksyran annars?
Det är det värde du har fått fram, även om det inte stämmer särskilt bra med värdet från Wikipedia (4.756).
Varför har den inte det? Då antar jag att den inte heller har något Ka värde, eller?
Korrekt slutsats. För att det inte finns några HCl-molekyler kvar, så [HCl] = 0 och man får inte dividera med 0.
Smaragdalena skrev:plzhelpmath skrev:Smaragdalena skrev:Du har missat att HCl är en stark syra, så den har inte något pKa-värde. Syrakonstanter gäller för en SYRA, inte för NaOH.
Stämmer pKa-värdet för ättiksyran annars?
Det är det värde du har fått fram, även om det inte stämmer särskilt bra med värdet från Wikipedia (4.756).
Varför har den inte det? Då antar jag att den inte heller har något Ka värde, eller?
Korrekt slutsats. För att det inte finns några HCl-molekyler kvar, så [HCl] = 0 och man får inte dividera med 0.
Hur kommer det sig att mitt värde blivit så annorlunda?
Såhär ser min titrerkurva ut: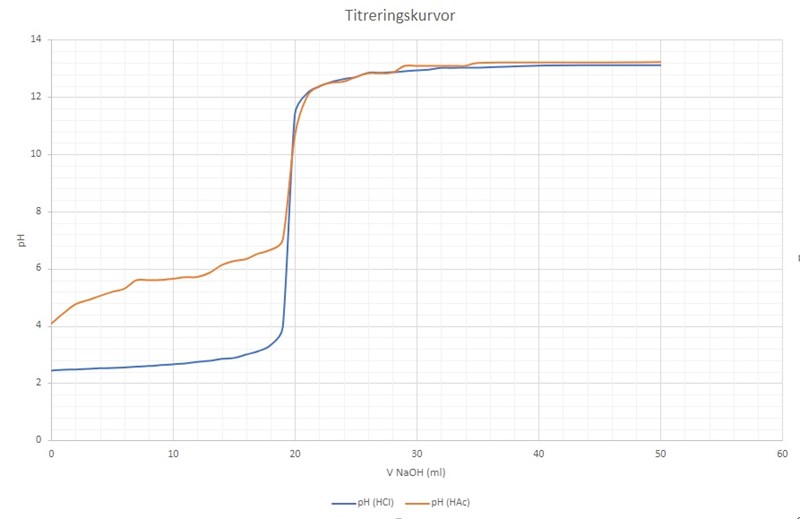 Är det något som inte stämmer?
Är det något som inte stämmer?
Kan man t ex veta om pH-elektroden är korrekt kalibrerad?
Smaragdalena skrev:Kan man t ex veta om pH-elektroden är korrekt kalibrerad?
Jag utgick från en videolaboration som vi ska använda till att skriva laborationen så det är inget jag gjort själv, antar att den ska va rätt kablibrerad?
Jag tycker att de som har gjort videolaborationen borde ha sett till att resultatet skulle bli rätt. Det är ingenting du kan rå för.


