Lewisformlerna för SeO2 och SeO3
Hej!
I denna uppgiften ska man rita lewisformlerna för SeO2 och SeO3 och avgöra om de är polära eller ej. Vi har fått lära oss ett antal ''informella regler'' som t.ex att elektronerna ska arrangeras så att centralatomen får den formella laddningen 0, att den formella laddningen på de ingående atomerna helst inte ska understiga eller överstiga 1, att laddningsfördelning hos atomerna är önskvärt samt att om en atom har plats i d-orbitalen (grundämnen från period 3 och vidare, dvs. fosfor och tyngre) kan ”oktetten” ökas till 10 eller även 12 elektroner.
Det här är de lösningar vi har fått på uppgiften. Jag har en del tankar om dessa. Med avseende på den sista ''regeln'' undrar jag t.ex varför man inte hade kunnat överskrida oktetten hos selen som ju är tyngre än fosfor. I exemplet med SeO2 hade ju en extra dubbelbidning till det högra syret inneburit att den formella laddningen hos de ingående atomerna hade reducerats till 0, 0, 0 istället för 0,1,-1 som den är nu. Jag köper att 0,1,-1 inte är helt orimliga laddningar, men vad som är mer iögonfallande är kaske exemplet med SeO3. Där är de formella laddningarna hos de innegående atomerna 0,-1,2,-1 vilka hade kunnat reduceras till 0,-1,1,0 med en ytterligare dubbelbidning till selen. Varför gör man inte detta? Är det inte ett tillräckigt energimässsigt gynnsamt alternativ?
Tacksam för hjälp!
Tillägg: Kan det kanske bero på att selen är mindre elektronnegativt än syre och att det därför är orimligt att selen erhåller flest elektroner?
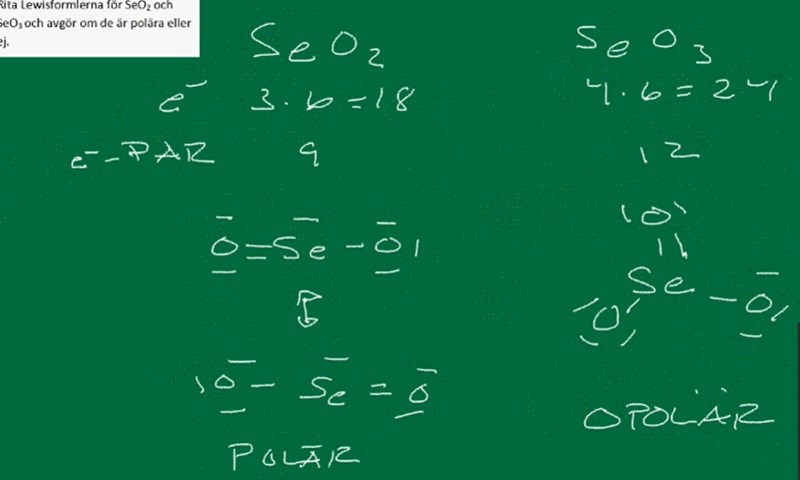
Ditt tillägg verkar helt rätt tänkt.


