Mättad lösning
Hej!
Jag undrar vad det är som gör så att en lösning blir mättad, vad är det egentligen som det beror på. Har försökt googla upp lite och fick fram att det är när en lösning inte löser upp mer av ett ämne. Men detta leder till min andra fråga, hur man kan undvika/förbättra så att en lösning inte blir mättad, jag tänker exempelvis vid laborationer?
Skulle verkligen uppskatta om någon kunde förklara detta för mig så att jag på bästa sätt kan förstå detta!
Tack på förhand!
Vad är det för erfarenhet som gör dig fundersam?
I praktiken är det helt enkelt så att en vätska (ett lösningsmedel) endast kan packa in en begränsad mängd andra molekyler eller joner mellan sina egna molekyler innan det 'blir fullt'. En lösning är mättad när det potentiella utrymmet för det som ska lösas upp blivit fullt.
Utifall det inte fanns en mättnadsgräns så skulle även en begränsad vätska kunna lösa upp alla fasta ämnen på jorden vilket vore mer överaskande och bessynnerligt. Jämför med att hälla en vattendroppe på en sockerbit. Vattnet sprider ut sig och löser upp en del socker men den kan inte 'äta upp' hela sockerbiten och bilda en vätska som innehåller hela sockerbiten. Vad som istället vore underligt vore om vätskor inte blev mättade för då skulle en droppe på en sockerbit kunna skapa en flytande vätska som innehåller pyttelite vatten och jättemycket socker.
Sedan är det såklart intressant vad det är som påverkar 'mättnadsgränsen' och varför lösningmedel är kan lösa olika mycket av olika ämnen. Varför kan en liter vatten lösa upp 200 g socker men 360 g salt är en bra fråga... (värden bara snabbtagna från wiki så ingen starkt källa eller kontroll kring de värdena)
Okej, till din fråga har jag en följdfråga, varför kan exempelvis kopparsulfatlösning lösa sig bättre än en bit zink? Är det på grund av att zink fortfarande är i fast form och kopparsulfaten är i flytande?
En lösning är redan löst så frågan är lite svårttolkad.
Men om jag tolkar om det på följande sätt:
Om man har en blå kristall av kopparsulfat (fast) och en silvrig bit av zink (fast) i två olika kärl med vatten så kan ganska mycket av kopparsulfatkristallen lösa upp sig innan lösningen blir mättat medan zinkbiten inte kommer att lösa upp sig alls så att vattnet är 'mättat på metalliskt zink' redan när den innehåller noll zinkmetall.
I det fallet handlar det om att jonföreningar som kopparsulfat är mer lättlösliga än metallföreningar som är olösliga. Joner kan ta plats i vatten och ryms bättre eftersom vattenmolekylerna orienterar sig så att de skapar ett utrymme för jonerna medan metallatomer inte kan binda på det sättet och sitter fast i metallytan så hårt att de inte kommer lossna av att vattnet stöter mot den.
Eller tänker du på vad som händer när man ta en blå vätska av kopparsulfatlösning och blandas den med klart rent vatten?
Sedan kanske det är så att jag ska tolka vad som händer om en zinkbit läggs i en kopparsulfatlkösning och hur de reagerar på varandra men det är något helt annat än vad som kan beskrivas med mättnadsbegreppet.
SeriousCephalopod skrev:En lösning är redan löst så frågan är lite svårttolkad.
Men om jag tolkar om det på följande sätt:
Om man har en blå kristall av kopparsulfat (fast) och en silvrig bit av zink (fast) i två olika kärl med vatten så kan ganska mycket av kopparsulfatkristallen lösa upp sig innan lösningen blir mättat medan zinkbiten inte kommer att lösa upp sig alls så att vattnet är 'mättat på metalliskt zink' redan när den innehåller noll zinkmetall.
I det fallet handlar det om att jonföreningar som kopparsulfat är mer lättlösliga än metallföreningar som är olösliga. Joner kan ta plats i vatten och ryms bättre eftersom vattenmolekylerna orienterar sig så att de skapar ett utrymme för jonerna medan metallatomer inte kan binda på det sättet och sitter fast i metallytan så hårt att de inte kommer lossna av att vattnet stöter mot den.
Eller tänker du på vad som händer när man ta en blå vätska av kopparsulfatlösning och blandas den med klart rent vatten?
Sedan kanske det är så att jag ska tolka vad som händer om en zinkbit läggs i en kopparsulfatlkösning och hur de reagerar på varandra men det är något helt annat än vad som kan beskrivas med mättnadsbegreppet.
Vet du om mättnaden också kan bero på tiden, exempelvis att kopparsulfatlösningen har stått i en bägare utan lock ganska länge och därför blir den mättad eller beror det på något helt annat?
Bara ett förtydligande: Ordet mättad i kemisammanhang kommer från samma ord som att 'äta sig mätt' dvs att bli full.
En lösning är mättad på ett visst ämne, dvs 'full', när den inte kan absorbera mer av ett ämnet.
Det kan ta tid för en lösning att bli mättad eftersom det tar tid för ett ämne att lösa upp sig men tid påverkar inte var maximala koncentrationen (gränsen) ligger.
Men den faktiska mättnadsgränsen, maximala koncentrationen för ett ämne i ett lösningsmedel, är endast beroende av temperatur.
Om du löser upp salt i kokande vatten tills det inte längre kan lösa upp något mer och låter det svalna så kommer saltkristaller att 'fällas ut' eftersom mättnadsgränsen sjönk och det som inte längre 'får plats' måste lämna vätskan. Det som spelar roll där är dock inte tiden i sig utan att temperatur kan förändras över tid.
Så hur har kopparsulfatlösningen löst sig är det genom att man har kokat den?
Den skulle löst sig även om man inte värmt vattnet. Skälet till att man värmer vattnet är för att upplösningen ska ske snabbare.
Jämförelsen med vardag är följande: Lägger du en tesked socker i kallt vatten och en tesked socker i varmt vatten och rör runt i båda så löser sockret upp sig i båda glasen men det går snabbare i det varma vattnet.
Något man märker om man dricker te med socker i alla fall.
Men jag har hört talas om att en lösning också kan få en beläggning? Jag förstår inte vad beläggning är och hur man kan göra för att en lösning inte ska få en beläggning.
En beläggning är ett tunnt ytlager av ett fast ämne på ytan av en behållare eller ett kärl.
En lösning kan inte få en beläggning men kärlet som lösningen ligger i kan få en beläggning.
De två vardagliga exemplen på beläggning är
1. Plack och missfärgningar på tänderna. Fläckar och missfärgningar på tändernas yta som inte är karies kallas för tandbeläggning. Att något att lagt sig på ytan.
2. Bruna fläckar på insidan av tekoppar som bildas när ämnen som var lösta i te fastnar på ytan av tekoppen och bildar bruna ringar eller områden.
Beläggning uppstår huvudsakligen när ämnen som var lösta i en vätska fälls ut och bildar fasta platta klumpar på ytan av något annat.
Huruvida beläggning uppstår eller om kristaller formas i botten av ett kärl beror av hur väl ämnet fäster på färlets yta. En väldigt slät glasyta har ofta svårare att få en beläggning än en posös och skrovlig keramikyta. Men detta är något som är väldigt beroende av sammanhang.
Beläggningar kan även bildas genom andra processer så som kemiska reaktioner, men avser ett tunnt ytlager av ett ämne som bildast ovanpå ytan av ett annat ämne.
I ditt exempel med zink i kopparsulfat (i en annan tråd) kan man säga att det bildas en beläggning av koppar på ytan av zinkbiten.
Men kan det inte bildas en beläggning på bara kopparsulfaten i och med att den har stått utan lock ganska länge, asså jag tänker innan man ens lägger en bit zink i lösningen? Jag undrar också om avlagringar är detsamma som beläggning?
abcdefghijklmo skrev:Men kan det inte bildas en beläggning på bara kopparsulfaten i och med att den har stått utan lock ganska länge, asså jag tänker innan man ens lägger en bit zink i lösningen? Jag undrar också om avlagringar är detsamma som beläggning?
Förstår inte vad du menar med 'på kopparsulfaten' då kopparsulfaten finns i vattnet (lösningen) och en beläggning bildas på något fast och inte något flytande.
Om man har en mättad kopparsulfatlösning som har en högre temperatur än rumstemperatur och inväntar att den svalnar till rumstemperatur så förväntar man sig att det fälls ut en del kopparsulfatkristaller (hydrat), ja, eftersom den går från att vara mättad till att vara övermättad. Men dessa kommer att vara distinkt blå och ha rombisk form så de kan inte misstas för metalliskt koppar eller något annat.
(1) Kopparsulfatkristaller som bildar vid utfällning via nukletion är distinkta kristaller och inte utspridda ytlager så det kan inte kallas beläggning eller avlagring. En beläggning är bildandet av en yta. När kopparsulfat fälls ut så bildar de 'klumpar'.
(2) Avlagring är effektivt synonymt med beläggning, visst. Avlagring används dock mig veterligen inte som ett tekniskt begrepp i kemin utan används vardagligt i sammanhanget 'kalkavlagringar' och när suspensioner (snarare än lösningar) resulterar i lager av sediment i botten av en vätska. Ord används dock i sammanhang som ger dem mening snarare än att de har mening själva.
Kan en beläggning ske på zinkpulver eller gäller det enbart på en bit av zink?
Zinkpulver är helt enkelt små zinkbitar.
Det är ingen kemisk skillnad mellan små zinkbitar och stora zinkbitar utan de reagerar på samma sätt.
Anledningen till att man i kemin kan vilja hacka upp saker i mindre bitar är att det ger en större ytarea över vilken kemiska reaktioner kan ske. Reaktioner sker då snabbare.
Illustration med hur ytarean ökar när man hackar upp en kub i mindre kuber
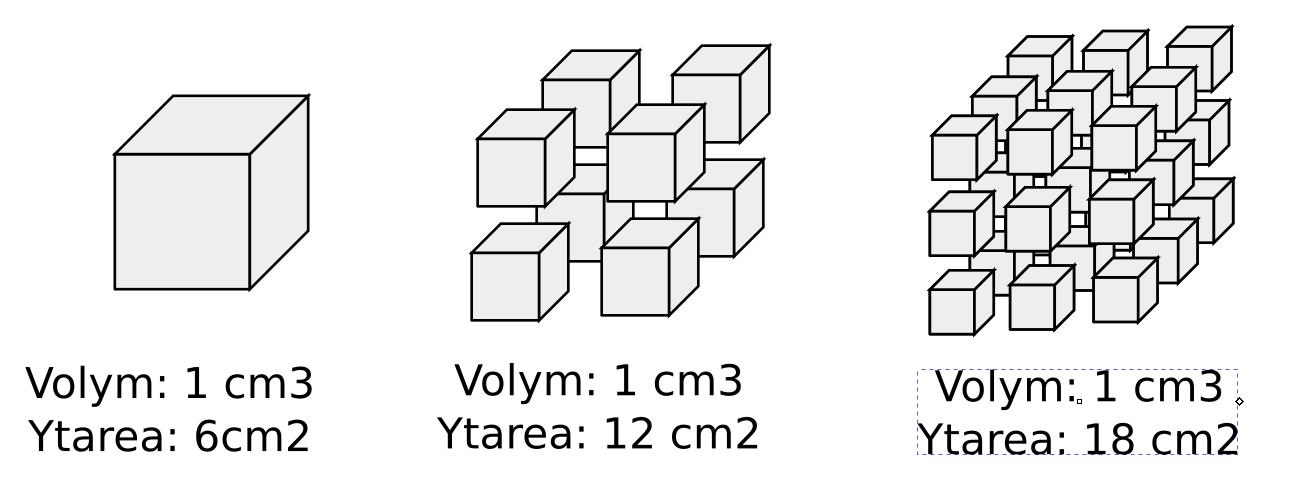
Men det slutar inte vara zink för dess skull så är ingen skillnad kemiskt. Skillnaden mellan pulver och större bitar är fysisk och inte kemisk.
Så då antar jag att det kan ske en beläggning på båda?
Allt som har en fast yta kan få en beläggning.
Har zinkpulver en fast yta?
abcdefghijklmo skrev:Har zinkpulver en fast yta?
Javisst, naturligtvis. Zink är ett fast ämne. Ett fast ämne har en yta.
Okej, men har hört min lärare säga att en kopparsulfatlösningen inte var jämn vid labben som vi gjorde, men förstår inte riktigt vad som menas med att den inte är jämn?
Jämn är inte en kemisk term så du hörde antingen fel eller så går det bara att avgöra från sammanhanget.
Jag tror det är bäst att du gör en sammanställning av dina kvarvarande frågeställningar och mejlar dem till din lärare.
Du har dragit iväg på en del spår som kanske inte är relevanta. Som Smaragdalena skrev i en annan tråd så var din lösning sannolikt inte i närheten av mättad så det är nog viktigare att identifera vad du behöver veta och förstå för att färdigställa rapporten/analysen snarare än att reda ut varje individuell detalj som kanske spelade roll.
abcdefghijklmo skrev:Okej, men har hört min lärare säga att en kopparsulfatlösningen inte var jämn vid labben som vi gjorde, men förstår inte riktigt vad som menas med att den inte är jämn?
Det får du fråga din lärare om. Vi vet inte vad som händer i hens huvud. Hade man inte skakat lösningen tillräckligt när den bereddes? Det finns i alla fall ingen anledning att tro att den var mättad om det stämmer som du har skrivit tidigare att den hade koncentrationen 0,5 mol/dm3.
Har för mig att hen sa att man inte hade skakat tillräckligt, kan det vara en orsak till att den inte var jämn?
abcdefghijklmo skrev:Har för mig att hen sa att man inte hade skakat tillräckligt, kan det vara en orsak till att den inte var jämn?
Ja, men det låter osannolikt klantigt. Även m den inte var tillräckligt välblandad borde den ha jämnat ut sig om den fått stå några dagar - men den kanske var nygjord på ett alltför snabbt sätt?
Jag tror att en tidigare klass redan hade använt allt material som vi skulle använda och kopparsulfatlösningen stod i rumstemperatur i en bägare, kan det ha nåt med det att göra?
När man skall bereda en lösning bör man använda en mätkolv och blanda till det i, inte en bgare. Det är praktiskt taget omöjligt att mäta en korrekt volym om man försöker mäta i en bägare.
Kopparsulfatlösningen stod redan i en bägare, så kan en metodförbättring vara att använda en mätkolv?
Jag har ingen aning. Fråga din lärare!
Vet du om det skulle göra någon skillnad att lägga kopparsulfatlösningen i muggar istället för en bägare?




