NADH/NAD+
Jag har sett bilder som visar att NAD+ --> NADH + H^(+) men har inte förstått hur H^(+) blir till i reduceringen av NAD+. Någon som kan förklara?
Sen tycker jag det är förvirrande med reducering och oxidering när det inte enbart är elektroner som flyttas (tex Fe2+ --> Fe3+). Hur ska man veta att det just är en reducering eller oxidering när man går mellan NAD+ och NADH?
Quacker skrev:Jag har sett bilder som visar att NAD+ --> NADH + H^(+) men har inte förstått hur H^(+) blir till i reduceringen av NAD+. Någon som kan förklara?
Sen tycker jag det är förvirrande med reducering och oxidering när det inte enbart är elektroner som flyttas (tex Fe2+ --> Fe3+). Hur ska man veta att det just är en reducering eller oxidering när man går mellan NAD+ och NADH?
Reaktioner med NAD+/NADH skrivs ofta väldigt slarvigt och översiktligt. Även i läroböcker på universitetsnivå kan det vara så förenklat att det blir svårt att förstå vad som händer i detalj. Det är nästan tio år sedan jag hade anledning att kolla ordentligt, men jag minns åtminstone en populär cellbiologibok där det faktiskt stod fel! Specialiserade biokemiböcker är ofta bättre än cellbiologiböckerna, så håll dig till dem om du har tillgång till båda.
Men om man ska försöka bena ut det så ser det ut så här i grundfallet:
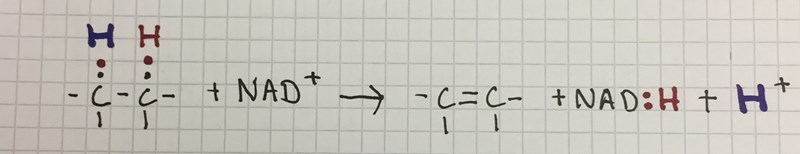
NAD+ kan ta emot en H+ och två elektroner från en annan molekyl. I bilden har jag bara ritat "den andra" molekylen som två kol med varsin väte, de andra atomerna visar jag inte.
I bilden har jag ritat bindningarna till H som två prickar, där varje prick är en elektron. De svarta stannar och bildar dubbelbindningen, de röda går till NAD+ och är med och bildar NADH. Den röda H går också till NADH.
Sedan blir det ju en väte över, som jag har ritat blå. Det är den som man ofta slarvar med när man skriver reaktionsformler. Jag har skrivit den som H+, som konventionen bjuder, men i verkligheten finns det ju inga fria H+ i en cell.
Det vanligaste är ju att den reagerar med vatten, H+ + H2O -> H3O+. I de fallen borde man ju egentligen skriva reaktionen så här:
H20 + "annan molekyl med enkelbindning" + NAD+ -> H30+ + "annan molekyl med dubbelbindning" + NADH
Men i dessa fall kan jag ändå tycka att det vanliga sättet att skriva är helt OK. Det är väldigt vanligt att man skriver H+ i stället för H3O+ i vanliga syra/basreaktioner, så det är kanske inte så stor risk för missförstånd här.
Det som däremot är problematiskt är att i vissa fall fungerar det annorlunda med den H+ som jag har ritat som blå. Det finns reaktioner som går i flera steg. Då kommer "den blå" H+ in från lösningen i ett tidigt steg, binder till någon molekyl, plockas loss i reaktionen med NAD+ och skickas ut till lösningen igen. Netto har det alltså inte bildats någon H+, men man skriver ändå ut den. Två exempel är de reaktioner som katalyseras pyruvatdehydrogenas (pyruvatets väg in i citronsyracykeln) och av alfa-ketoglutaratdehydrogenas (bildandet av succinyl-CoA i citronsyracykeln). Även wikipedia slarvar i sin översiktliga artikel, men gör rätt om man läser om alfa-ketoglutaratdehydrogenas.
Om du inte har någon riktig biokemibok kan du läsa här:
https://www.ncbi.nlm.nih.gov/books/NBK22427/
Ta dig gärna tid att följa elektroner och H+ noga genom reaktionerna!

