Periodiska systemet
Hej! visst är varje grupp i det periodiska systemet hur många valenselektroner grundämnet har, men enligt oktettre regeln kan det bara finnas 8 valenselektroner i valensskalet. Så varför finns det då grupp 9-18?
Väldigt bra fråga. Faktum är att det finns grupper där alla grundämnena inte har lika många valenselektroner. T.ex i grupp 9 har Kobolt, Co bara två valenselektroner medan Rhodium, Rh bara har en valenselektron.
Man brukar läsa grupperna från 1-2 och skippa (3-12) och sedan fortsätta på grupp 13, dvs 3, 4, 5 osv...
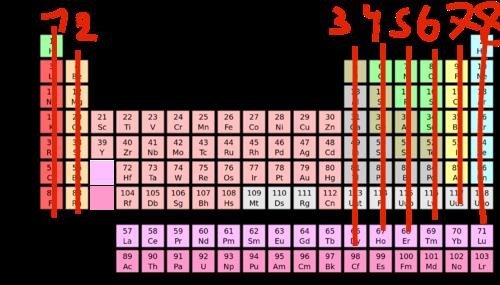
Nu ser det väl klart ut! (Skippa lantanider och aktinider, dvs blocket under)
man skippar inte
Alla elektroner i samma skal har inte samma energi, utan det finns plats för 2, 6, 10, 14 stycken på varje undernivå. Från och med tredje skalet finns det plats för mer än 8 elektroner, men ändå finns det inte mer än 8 elektroner i atomens yttersta skal. Hur kan detta hänga ihop?
Det tredje underskalet i det tredje skalet har lägre energi än det första underskalet i det fjärde skalet, så när man fyllt på 8 elektroner i skal 3 hamnar de två nästa elektronerna i skal 4, så man börar på en ny period (raderna i periodiska systemet heter så). När det första underskalet i skal 4 är fullt forsätter man att fylla på skal 3 tills det verkligen är fullt - detta är de 10 grupperna (3-12) i "gropen" som kallas övergångsmetaller.



