pH justering med NaOH med alkalinitet
Jag har vatten med pH 6,2 som önskas höjas till pH 8,3 med tillsats av lut (NaOH). Vattnet innehåller vid pH 6,2 löst CO2 och en alkalinitet motsvarande 55 mg HCO3-/L vatten. Jag ska beräkna mängden NaOH som behöver tillsättas.
Jag har beräknat mängden löst CO2 vid pH 6,2 mha 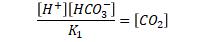 där [HCO3-] fås med molvikten 61 mg/L och K1= 10^-6,35 vilket ger 1,274 mmol/L CO2
där [HCO3-] fås med molvikten 61 mg/L och K1= 10^-6,35 vilket ger 1,274 mmol/L CO2
Sedan har jag karbonatsystemet:
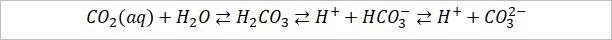
som förskjuts åt höger när pH höjs (H+ minskar) och där jag antar att all CO2 som fanns vid pH 6,2 har omvandlats till HCO3- vid pH = 8,3 dvs 1,274 mmol CO2 ger även 1,274 mmol H+.
För att beräkna lutmängden får jag då (en mol NaOH ger 1 mol OH- dvs minskar mängden H+ med en mol) : (10^-6,2+1,274*10^-3)-(10^-8,3) mol NaOH
Men jag tycker det verkar konstigt. Mängden lut bestäms ju då nästan enbart av mängden CO2. Önskat pH har ju nästan ingen betydelse. Tänker att det pH man får efter att ha tillsatt NaOH blir väldigt känsligt för om man råkar blanda in för mycket NaOH. Vad gör jag för fel?
Är det här verkligen en kemi 2-fråga? Jag tror dock att du har räknat rätt. Kollar man på grafen nedan så ser man att det börjar bildas många karbonatjoner efter ca pH 9. Det innebär att man skulle behöva tillsätta mycket mer natriumhydroxid ifall man vill gå över pH 9. Vill man höja pH från 6 ser man också att det behöver ombildas väldigt mycket koldioxid till vätekarbonat fram till ca pH 8 då man har en lösning som består av i princip ren vätekarbonat.
Man lurar sig själv lite, men det du just har upptäckt är ju kraften hos en buffert. Det krävs nästan ingen natriumhydroxid alls att gå från pH 6 till 8 i en lösning som inte är buffrande, men så fort man har buffrande ämnen så behöver man tillsätta betydligt mer av basen för att höja pH. Den lilla mängd som krävs för att just höja pH utan bufferten blir nästan försumbart liten.
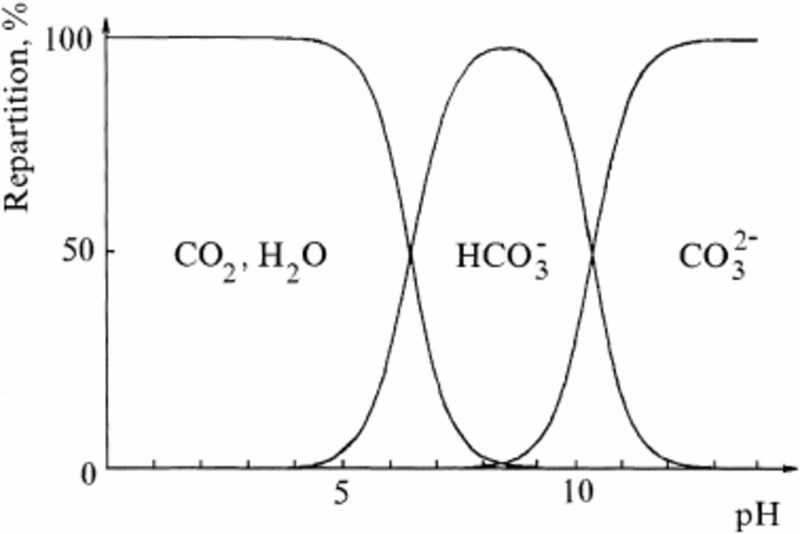
Tackar för svaret! Jo, det diagrammet hade jag som grund för antagandet att vid pH=8,2 finns ingen CO2 kvar utan den har helt omvandlats till HCO3-. Men oj vad starkt den buffrar om siffrorna stämmer.


