radikal
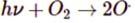
Varför bildas det två st fria syreradikaler? Borde det inte bildas två syreatomer?
P.S. "hv" står för ljusenergi
När ljusets klyver bindningen mellan syreatomerna i syrgasen, får varje syrgasatom en bindningselektron var. Och ämnen med oparad elektron i valensskalet är radikaler.
Orsaken till hur detta kan ske för syrgas kan förklaras med de elektronorbitaler och spinn som syreatomens elektroner kan finnas i, men denna förklaring är på universitetsnivå.
Okej, det där med en bindningselektron var, menar du då att varje enskild syreatom ser ut som på vänster bild?
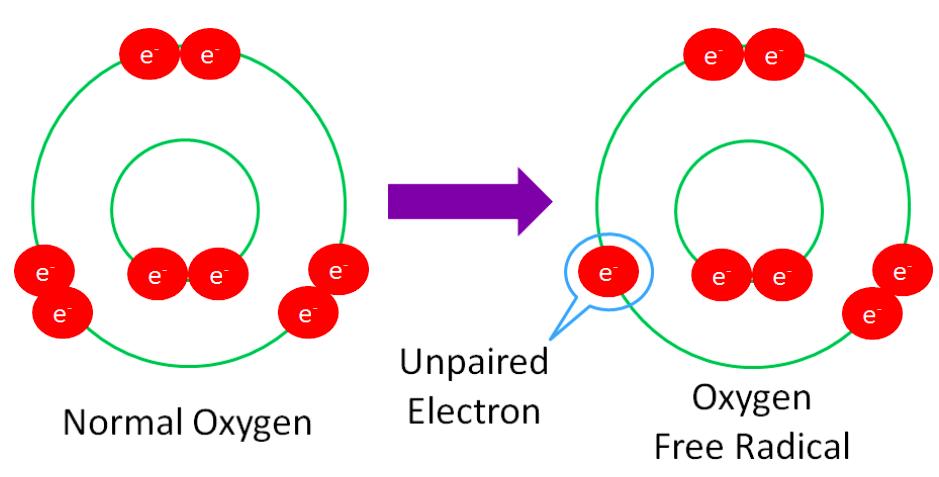
EDIT: Menar höger bild
Ja det är ett sätt att illustrera hur elektronerna är fördelade, efter att bindningen mellan atomerna i syrgasen bryts av ljuset.
Okej bara en grej till: Syrgas, O2, har totalt 12 valenselektroner. De två syreradikalerna som bildades i reaktionen har, som vi ser i höger bild, 5 valenselektroner var, det vill säga totalt 10 valenselektroner. Vad hände med resterande 2 valenselektroner? Försvann dem när dubbelbindningen klyvdes i samband med ljusenergin?
Den högra bilden visar en syreatom som har blivit av med en elektron, alltså en positivt laddad syrejon. Sådana är extremt ovanliga. Så fort den skulle bildas borde den reagera med nästan vadsomhelst.
Varifrån kommer din formel? Handlar det om ozonskiktet?
Aaa precis, ozonskiktet. Detta är källan: https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/07%3A_Case_Studies-_Kinetics/7.03%3A_Depletion_of_the_Ozone_Layer
Hursomhelst, varför är det en positivt laddad syrejon och inte en syreradikal?
Under vissa omständigheter kan en syrgasmolekyl klyvas så att det blir en positivt och en negativt laddad jon, som båda är radikaler. I ozonlagret är det så långt mellan de få partiklar som finns att radikalerna inte har någon att reagera med, så ärför reagerar du inte så snabbt som de skulle ha gjort här nere hos oss.
Hur kan det bildas två syreradikaler i reaktionen? En syreatom har ju 6 valenselektroner och därför är elektronerna alltid parade. Det borde inte alltså kunna gå att bilda två syreradikaler från en syremolekyl
Av syremolekylens 12 valenselektroner hamnar 5 på den ena syreatomen och 7 på den andra. Båda jonerna har en oparad elektron. Det gårinte ihop om det skulle bildas nånting som både är en radikal och oladdat.


