Reduktionspotentialer - byte av lösningsmedel från vatten
Föreläsare tog upp att reduktionspotentialer ofta är mätta med vatten som lösningsmedel.
Det till höger i bilden, under "complex formation", menade han på visade detta. Att skillnaden i reduktionspotentialen för Fe3+ går från +0.77 V till +0.36V när man löser Fe3+ i CN- istället för i vatten.
Men jag hänger inte med. Kollar man i tabellens röda rutor är det väl Fe3+ löst i vatten jämfört med [Fe(CN)6]3+ löst i vatten. Mao inte att man bytt lösningsmedlet mot CN-. Någon som kan ge lite hjälp här om han har rätt, hur man ska tänka?
Jag är givetvis med på att beroende på vad som "sitter på" joner så kan deras förmåga att skicka iväg/ta emot elektron/-er till andra specier påverkas - även om jag inte vet hur potentialen påverkas, åt vilket håll, och varför.
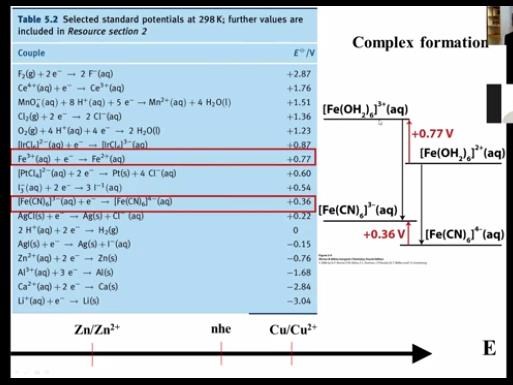
Kollar man i tabellens röda rutor är det väl Fe3+ löst i vatten jämfört med [Fe(CN)6]3+ löst i vatten. Mao inte att man bytt lösningsmedlet mot CN-. Någon som kan ge lite hjälp här om han har rätt, hur man ska tänka?
Exakt, det är vad figuren visar. Jag gissar att du missförstod vad din föreläsare menade. Det är nog bara föreläsaren som kan svara på vad hen egentligen menade.
Nja han sa bokstavligt så. Men då vet jag i alla fall att jag tänker rätt!
Men om man tar hur standardpotentialer faktiskt ändras med lösningsmedel - om det går att förklara på en lägre nivå då jag inte läst så mycket kemi. Om man tex skulle lösa Fe3+ i vatten jämfört med CN-. Hur skulle potentialen kunna ändras, när blir den högre och när blir den istället lägre (tänker om lösningsmedlet har egenskapen x så kommer potentialen att bli högre jämfört med i vatten, och egenskapen y gör att den blir lägre)? Och skulle alla i det nya lösningsmedlet lösta specier bete sig på samma sätt?
Man kan inte läsa järnjoner i cyanidjoner. Cyanidjoner är inte ett lösningsmedel. Däremot kan man ha en vattenlösning av järnjoner med eller utan cyanidjoner. Järnjoner binder starkare till cyanidjoner än till vattenmolekyler och därför är komplexbildningen med cyanidjoner mer exoterm. Jag vet inte hur entropin ändras i just detta fall, men många ligander kan binda kelatiskt till centralatomen och det är väldigt gynnsamt då det ökar entropin ganska mycket. Om en reaktion är exoterm eller ökar entropin kan det leda till en sänkning av Gibbs fria energi och det innebär en högre potential enligt sambandet .
Samma sak gäller om du har ett helt annat lösningsmedel. Om lösningsmedlets molekyler binder starkare till ämnet eller om det ger en större ökning (eller mindre sänkning) av entropin så kommer det ge en större potential.
Är du med på det?


