sjunkande kokpunkt
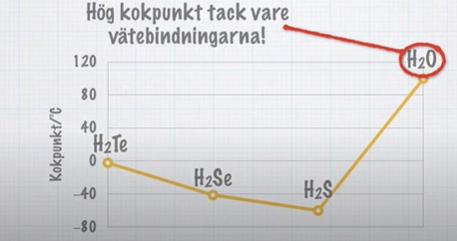
hur kommer det sig att kokpunkten sjunker från divätellurid till diväteselenid till divätesulfid?
har det något med bindningarna att göra?
Det är storleken hos molekylerna som är där och spökar igen… Hur påverkar det vdW-bindningarna?
Teraeagle skrev:Det är storleken hos molekylerna som är där och spökar igen… Hur påverkar det vdW-bindningarna?
Ju större molekylerna är desto starkare blir VDW bindningarna?
Just det
Teraeagle skrev:Just det
Hur kan man se molekylens storlek endast genom formelenhet? ( är det genom antalet index-tal och atomer?)
Man kan t.ex. konstatera att O, S, Se och Te ligger i samma grupp där Te är tyngst/störst/har högst atomnummer. Då blir H2Te den största molekylen av dessa.
Annars kan man beräkna ämnenas molmassa. Det är ett ganska bra mått på molekylens storlek.
Teraeagle skrev:Man kan t.ex. konstatera att O, S, Se och Te ligger i samma grupp där Te är tyngst/störst/har högst atomnummer. Då blir H2Te den största molekylen av dessa.
Annars kan man beräkna ämnenas molmassa. Det är ett ganska bra mått på molekylens storlek.
vi har inte räknat med molmassa, men det kommer nog framöver och ska kika på det. tack!
(visst är det så att ju längre ner man går i gruppen = mer antal elektroner = större )?
men om man går åt höger i period = mindre radie?
Apropå molmassa... På vilket sätt kan man se på molmassan ifall en molekyl är större än en annan?
Om vi tar exempelvis H2O och H2S.
Vatten har en molmassa på 18.02 g/mol medan svavelväte har en molmassa på 34.06 g/mol.
Hur ska man utifrån detta avgöra vilken som är störst? Visserligen väger svavelväte dubbelt så mycket per mol, men detta säger oss inget om exempelvis atomradie.
Man behöver inte göra det onödigt komplicerat. Om man gör en jämförelse kommer man se en trend där bindningsstyrkan korrelerar med molmassan. Är det massan som avgör bindningsstyrkan? Nej, men sambandet finns där och kan ändå användas för att förutspå vilken molekyl som kommer ha starkast vdW-bindning.
Det är mycket riktigt atomernas storlek och antalet elektroner som avgör styrkan på bindningarna, men inte minst det sistnämnda (antalet elektroner) samvarierar med molmassan. Inom samma grupp, som i detta fall, finns även ett starkt samband mellan molekylens vikt och storlek.
Teraeagle skrev:Är det massan som avgör bindningsstyrkan? Nej, men sambandet finns där och kan ändå användas för att förutspå vilken molekyl som kommer ha starkast vdW-bindning.
Ja, eller i boken står det
"Med ökande atommassa ökar även antalet elektroner i en atom. Det innebär att fler elektroner tillfälligt kan fördela sig ojämnt i atomen. van der Waalsbindningarna mellan atomer blir alltså starkare ju fler skal de har eller helt enkelt när det finns fler elektroner i atomerna. "
Alltså är det
Ju fler elektroner --> fler skal --> större atommassa --> större molekyl --> starka vdW bindningar. ?



