Substitutions mekanismen
 denna reaktion sker under ett steg
denna reaktion sker under ett steg
 medans denna reaktion sker under två steg,
medans denna reaktion sker under två steg,
men vad är det som gör att det är så?
är det just att kolet på andra exemplet är sekundär som gör att det sker i två steg eller vad är anledningen till denna olikhet?
Kolet i det andra exemplet är inte sekundärt utan tertiärt. Tertiära alkylhalider (som exempelvis den tertiära butylkloriden i ditt exempel) bildar generellt ganska stabila karbokatintermediärer och därför brukar SN1 gynnas över SN2.
Dessutom är substratet i ditt exempel ganska steriskt hindrat. Det centrala kolet är sp3-hybridiserat så man kan förvänta sig en tetraedergeometri. I en SN2-reaktion angriper nukleofilen det centrala kolet "bakifrån", och det går inte så lätt när det finns bulkiga metylgrupper i vägen:
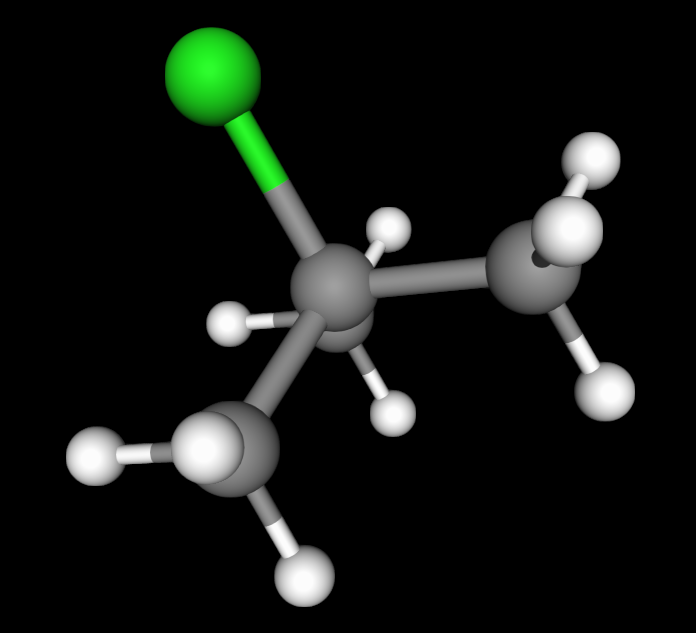
okej så det är alltså trångt för OH- att attakera kolet då den är bunden till andra kolatormer, har jag uppfattat det rät?
vad menas med sp3-hybridiserat ? att den är bunden till tre väteatomer?
Ja, det är "för trångt".
Hybridisering är en del av valensbindningsteorin och ni kanske inte har diskuterat det. I så fall kan du strunta i det jag skriver nedan.
I det här fallet innebär det att en 2s-orbital har "blandats" med tre 2p-orbitaler och bildat fyra sp3-orbitaler som alla har en elektron var. Grundtillståndet för kolatomen är
C: 1s22s22px12py12pz0
Som du ser är en av orbitalerna som skulle kunna delta i orbitalöverlapp tyvärr redan full (och dessutom har en s-orbital lägre energi än en p-orbital i samma skal) och en är istället helt tom. Så hur kan kol göra fyra bindningar? Det beror på att det sker orbitalhybridisering; 2s-orbitalen blandas med de tre 2p-orbitalerna och bildar fyra sp3-orbitaler med lika stor energi och en elektron var. Nu finns det alltså fyra orbitaler som är redo för överlapp:
*C: 1s22(sp3)4
Om en atom är sp3-hybridiserad kan man förvänta sig en tetraedrisk geometri runt den atomen. Då ser man att det blir problematiskt att försöka angripa kolet genom en SN2-reaktion eftersom de bulkiga metylgrupperna "hindrar nukleofilen från att ta sig förbi".
naytte skrev:.....
Om en atom är sp3-hybridiserad kan man förvänta sig en tetraedrisk geometri runt den atomen. Då ser man att det blir problematiskt att försöka angripa kolet genom en SN2-reaktion eftersom de bulkiga metylgrupperna "hindrar nukleofilen från att ta sig förbi".
Vi har bara läst översiktligt vad orbitaler förra året, så vi har inte läst om valensbindningsteorin,
Men jag tror jag förstår nu varför det blir två steg i den andra reaktionen,
tack för hjälpen och förklaringen!!
Ingen orsak!
Det kan vara bra att nosa lite på VB-teori eftersom den är väldigt användbar för att förutspå geometrier lokalt. Khan Academy har en del bra videor och artiklar om det som förklaras på ett grundläggande men användbart sätt (man har kokat bort all underliggande matematik och kvantkemi och diskuterar endast hur man tillämpar det). Exempelvis låter det en se direkt att en kolatom med två -bindningar måste vara sp-hybridiserad, eftersom den tydligen har kvar två p-orbitaler, etc.
okejjj tack för tipset! ska kika mer på det ikväll! :)



