Sulfatjon
Hej,
Vart kommer de två extra elektronerna i sulfatjonen ifrån? Kan en jon lämna elektroner helt och hållet till en annan utan att bindas till den?
I väntan på att en kemist svarar kan jag försöka förklara hur jag ser på det.
Titta på t.ex. svavelsyra i vattenlösning. Vattenmolekylerna är dipoler och har en negativt laddad "syreända". Dessa syreändor suger så att säga loss vätejoner från svavelsyran. Kvar blir sulfatjonen med elektroner från vätet. Vattnet drar hårdare i vätejonerna än svavelsyran.
En atom vill omge sig av ett fullt elektronskal, dvs oftast 8 elektroner (kallas oktettregeln)
Om man ritar upp alla valenselektroner i sulfatjonen ser den ut så här:
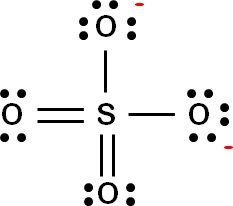 Som du ser är varje syreatom omgiven av 8 elektroner (strecken = två elektroner som delas mellan syre och svavel). För att
Som du ser är varje syreatom omgiven av 8 elektroner (strecken = två elektroner som delas mellan syre och svavel). För att
syret ska kunna fylla sitt yttersta skal krävs det två extra elektroner, vilket ger laddningen -2.
Var kommer elektronerna från då? Dem "snor" sulfatjonen från andra komponenter. Om man tittar på svavelsyra så ser den ut så här: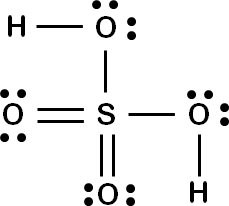 Så när syran dissocierar "snor" sulfatjonen en elektron från varje väte. Det bildas två positiva vätejoner och en sulfatjon.
Så när syran dissocierar "snor" sulfatjonen en elektron från varje väte. Det bildas två positiva vätejoner och en sulfatjon.
Tack för förklaringen.. Men jag förstår fortfarande sådär.. Jag tänkte bara på sulfatjonen, innan den reagerar med nåt ämne.. Vart ifrån har den dragit elektronerna.. och jag vet att alla atomer strävar efter att ha 8 valenselektroner, men svavel atom här i mitten får då 12 elektroner. Den borde nöja sig med 2 syre atomer, då har var o en av dem 8 valenselektroner.. Hur kan den reagera igen med två ytterligare syre atomer?
Asså joner finns aldrig fritt så som du tänker dig. Det finns inget ”innan” sulfatjonen reagerar med nåt annat ämne, det ingår alltid i något ämne (jonförening).
svavelatomen i sulfatjonen följer inte oktettregeln, varför den inte gör det behöver du inte veta. https://en.wikipedia.org/wiki/Hypervalent_molecule
Qetsiyah skrev:Asså joner finns aldrig fritt så som du tänker dig. Det finns inget ”innan” sulfatjonen reagerar med nåt annat ämne, det ingår alltid i något ämne (jonförening).
svavelatomen i sulfatjonen följer inte oktettregeln, varför den inte gör det behöver du inte veta. https://en.wikipedia.org/wiki/Hypervalent_molecule
Okej jag fattar tack..




