Syra-bastitrering
Hej vi fick i uppgift att identifiera två okända syror, malonsyra och citronsyra. Men vi vet inte vilket som är vilket. Detta är en labb inom analytisk kemi, vi utförde laborationen genom att titrera syrorna med NaOH, och sedan mäta av pH med en pH mätare för att få en titreringskurva på geogebra.
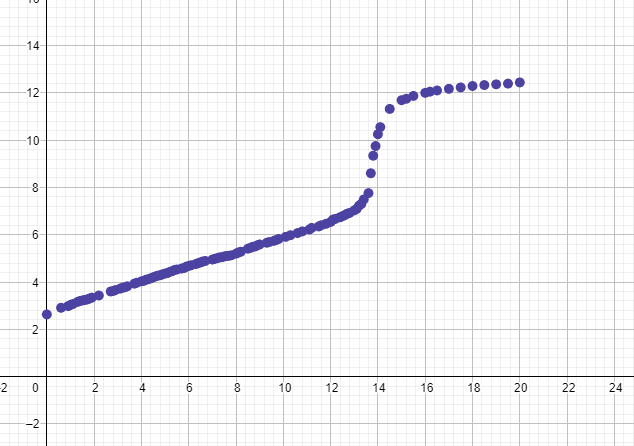
Nu i efteråt vet vi att denna kurva tillhör citronsyra, detta är väldigt konstigt då syran är treprotonig och ska ha tre titreringskurvor. Har ni någon aning om hur man ska beräkna pka utifrån denna, och varför det blev så. Mina klasskamrater fick en likadan kurva och folk på internet verkar ha fått samma. Vad beror det på egentligen?
Läs t ex i den här tråden, fast där fick man 2 ekvivalenspunkter för citronsyra, inte bara en.
den där man fick två ekvivalenspunkter tror vi är malonsyra. Värdena liknar den mer, men du pratade om något om en buffert, vad menas med det?
En buffertlösning är en (vatten)lösning som innehåller både en svag syra och dess korresponderande bas. En liten tillsats av stark bas eller stark syra ändrar nästan inte pH-värdet alls, fastän det skulle ändrat pH-värdet mycket,om man istället hade tillsatt samma mängd bas eller syra till en lösning av en stark syra (eller bas) med samma pH-värde.
typ att man får buffert effekter, trots att det inte finns en buffert
Jo, visst är det en buffert! Först är det citronsyra och divätecitratjoner fram till första (osynliga) ekvivalenspunkten, sedan är det divätecitratjoner och vätecitratjoner fram till andra EP,och sedan är det vätecitratjoner och citratjoner fram till EP3.
divätecitratjoner? vart ifrån kommer de, och vätecitrat?? kan du förklara mer snälla, jag uppskattar all hjälp
"För citronsyra så kan vi inte se den första ekvivalenspunkten, eftersom systemet innehåller hyfsat höga koncentrationer av både divätecitratjoner och vätecitratjoner, så lösningen är buffrad. Nästa ekvivalenspunkt ligger ungefär mittemellan pKa2 och pKa3, precis som man kan vänta sig." du skrev detta i den andra tråden, men jag förstår inte riktigt vad som menas. Hjälper det något om vi har syrornas koncentrationer från början?
Citronsyra ser ut så här: 
men jag väljer att skriva citronsyra som H3Ci. Då har vi följande jämvikter:
H3Ci + H2O <=> H2Ci+ + H3O+
H2Ci+ + H2O <=> HCi2+ + H3O+
HCi2+ + H2O <=> Ci3+ + H3O+
okej tänker man då, att första ekvivalenspunkten är den första raden du har skrivit. Vad är EP egentligen? Och varför är lösningen buffrad om det finns höga koncentrationer av både divätecitratjoner och vätecitratjoner, och hur vet du att det är det?
Det verkar som om du skall plocka fram din kemibok och läsa igenom kapitlet om svaga syror och baser. Återkom här når du har gjort det.
om vi tittar på kurvan så börjar pH vid, 2.63. Är inte det konstigt då pka1 är för citronsyra är 3.1. Min lärare vill inte att vi fokuserar på jämvikt och den där ekvationen du skrev för vi har inte gått igenom det, Det är vissa saker i kurvorna som indikerar att förändringar skulle kunna göras, men vaad
Vilket pH det är från början beror på syrans koncentration (och naturligtvis på vilken syra det är). Varför skulle det vara konstigt att pH är lägre än pKa1 från början?
inte att det är lägre, utan att intervallet är så kort. Så grafen hinner typ inte anpassa sig
fysikopium skrev:inte att det är lägre, utan att intervallet är så kort. Så grafen hinner typ inte anpassa sig
Menar du i x-led (ml tillsatt bas) eller i y-led (pH)?
jag menar i y-led. En fråga i förra tråden sa du ju att första ekvivalenspunkten inte syns för lösningen är buffrad pga höga konsentrationer divätecitratjoner och vätecitratjoner. Hur kommer det sig att den andra syns då, är lösningen mindre buffrad?
När man närmar sig den sista ekvivalenspunkten börjar syran ta slut, så då är inte lösningen buffrad längre (mot bas).
menar du att den enda ekvivalenspunkt som syns, föreställer egentligen ekvivalenspunkt 3?
fysikopium skrev:menar du att den enda ekvivalenspunkt som syns, föreställer egentligen ekvivalenspunkt 3?
Ja, det menar jag, eller nummer två om det är malonsyra.
 skulle du säga att denna slutsats är rätt?
skulle du säga att denna slutsats är rätt?
Ja, eller du kan skriva H3Ci + 3 H2O <=> Ci3- + 3 H3O+.
vilken rad är det där, den är väl balanserat såsom jag skicka den, är den inte?
Det är en summaformel för alla tre protolysstegen.


