Vad blir den totala entalpiförändringen?
Hej!
Jag behöver hjälp med uppgiften nedan.
Klorgas kan reagera med syrgas och bilda kloroxid enligt formeln
Cl2 + O2 + 276 kJ → 2ClO
a )Vad blir ΔH för reaktionen ovan? (1p)
b) Vad blir bildningsentalpin för ClO? (1p)
c) Kloroxid kan reagera vidare med syrgas enligt reaktionen
2ClO + O2 → 2ClO2 + 70 kJ
Vad blir ΔH för den totala reaktionen Cl2 + 2O2 → 2ClO2? (1p)
Jag har löst a och b, men inte c.
På c tänkte jag såhär:
Reaktion 1 - Reaktion 2 = Reaktion 3
(Cl2 + O2) - (2ClO + O2 → 2ClO2) = Cl2 + 2O2 → 2ClO2
Men det går inte ihop
Jag skulle inte våga räkna på den här uppgiften utan att göra ett diagram av den här typen.
Smaragdalena skrev:Jag skulle inte våga räkna på den här uppgiften utan att göra ett diagram av den här typen.
Hur ska jag rita diagramet?
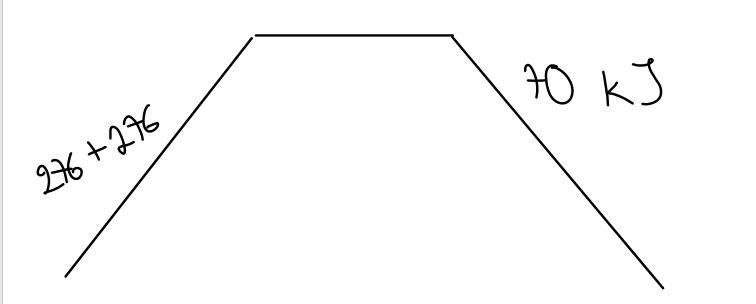
Är det så du menar?
Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Smaragdalena skrev:Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Jag tänkte att entalpin för reaktanterna var för sig var 276 kJ
Smaragdalena skrev:Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Jag förstår inte heller vad 70 kJ i reaktionsformeln står för. Är det entalpiförändringen?
rrt04 skrev:Smaragdalena skrev:Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Jag tänkte att entalpin för reaktanterna var för sig var 276 kJ
När 1 mol klorgas reagerar med 1 mol klorgas, så behöver man tillföra 276 kJ för att det skall kunna bildas 2 mol ClO. Det är alltså en endoterm reaktion.
rrt04 skrev:Smaragdalena skrev:Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Jag förstår inte heller vad 70 kJ i reaktionsformeln står för. Är det entalpiförändringen?
När 2 mol ClO reagerar med 1 mol syrgas frigörs det 70 kJ när det bildas 2 mol ClO2. Det är alltså en exoterm reaktion.
Smaragdalena skrev:rrt04 skrev:Smaragdalena skrev:Ungefär, men varför har du 2 stycken "276" på vänstersidan? Och produkten borde ligga en bra bit ovanför utgångsläget.
Jag förstår inte heller vad 70 kJ i reaktionsformeln står för. Är det entalpiförändringen?
När 2 mol ClO reagerar med 1 mol syrgas frigörs det 70 kJ när det bildas 2 mol ClO2. Det är alltså en exoterm reaktion.
Jaha, så det är entalpiändringen.
Vilken är alltså den totala entalpiändringen när 1 mol klorgas reagerar med 2 mol syrgas så att det bildas 2 mol ClO2?
Smaragdalena skrev:Vilken är alltså den totala entalpiändringen när 1 mol klorgas reagerar med 2 mol syrgas så att det bildas 2 mol ClO2?
206 kJ, (276-70)
...per mol
Smaragdalena skrev:...per mol
Varför blir det per mol? Jag har väl inte räknat ut hur mycket det frigörs när en mol kloroxid bildas
Nej, jag tänkte fel. 206 kJ/mol klorgas, 103 kJ/mol syrgas och 103 kJ(mol ClO2.
Smaragdalena skrev:Nej, jag tänkte fel. 206 kJ/mol klorgas, 103 kJ/mol syrgas och 103 kJ(mol ClO2.
Jaha, så svaret blir 206 kJ?


