Vad representerar en kemisk reaktionsekvation?
Hej!
Jag ställde nyligen en fråga om kemiska reaktionsekvationer som handlade om vad en kemisk reaktion relaterar för formella objekt. Jag sökte alltså någon slags analog till matematik, där varje symbol (inkl. t.ex. “”, “”, “”) har en rigorös definition och således en formell mening. Emellertid har jag insett att det var en dum fråga samt att det helt enkelt är ett sammanträffande att man använder matematiska symboler i kemiska reaktionsformler och att symbolerna i kemiska reaktionsekvationer (inkl. t.ex. “”,“”, “ ”) inte har samma slags formella mening som symbolerna i matematiska uttryck.
Istället är det kanske mer rimligt att tolka kemiska reaktionsformler som symboliska uttryck för formella, kemiska påståenden, men exakt hur man ska tolka dem är lite oklart. Låt oss för enkelhetens skull studera en reaktion
Om reaktionen är elementär skulle tolkningen kunna vara mycket enkel. Species krockar med species och producerar species , i det stökiometriska förhållandet .
Denna mycket trevliga tolkning kan dock inte stämma eftersom den pajar då vi börjar studera andra reaktionsformler, som exempelvis nettoreaktionen från Haber-Bosch-processen:
Här är det ju knappast så att gasformigt väte krockar med gasformigt kväve och bildar gasformig ammoniak. Så vad är tolkningen här? Vilket kemiskt påstående är reaktionsformeln ovan en symbolisk proxy för? Om vi är väldigt liberala med vad “reagera” betyder kan vi säga att det är en symbolisk omskrivning av “vätgas reagerar med kvävgas och bildar gasformig ammoniak”, men det känns extremt krystat eftersom ”reagera” då skulle behöva kunna innebära att två species som aldrig kommer i kontakt förrän många förändringar senare “reagerar”.
Kemiska reaktionsformler visar bara en nettoförändring från reaktanter till resultanter. Vilka reaktioner som faktiskt äger rum visas inte direkt genom en reaktionsformel. Att reaktionsmekanismer utelämnar viss intermediära reaktioner som leder till den "slutgiltiga" resultanterna handlar om att förenkla och göra det gripbart, för annars så blir det blir för komplicerat.
I exemplet med Haber-Bosch processen visas bara en rådande jämvikt mellan vätgas, kvävgas och ammoniak. Men inte NHx intermediärerna som bildades under "mellanreaktioner", eller hur väteatomerna ens adderades sekventiellt till kväveatomen.
Alltså beskriver reaktionsformel snarare en förändrint från A -> Z, då alla intermediärer där emellan framgår inte.
Hoppas det är svar på din fråga!!
Jag är förstås med på att vi behöver något sätt att abstrahera bort mekanistiska detaljer för att göra allting mer överskådligt. Däremot har jag lite svårt för det här med att en reaktionsformel bara skulle vara en svart låda som visar ”reaktanter” och ”produkter”. Ta exempelvis följande tillrättalagda exempel, där varje reaktion är elementär:
Om vi skulle studera ”nettoreaktionen” skulle det se ut som om sönderföll av sig själv för att bilda . Skulle det vara rätt att säga att vi endast hade som reaktant då, trots att vi uppenbarligen också hade med i början? Jag tycker det verkar väldigt märkligt.
I sådana fall skulle B betraktas som en katalysator för reaktionen, då den möjliggjorde reaktionen men förbrukades inte själv under processens gång.
Det skulle gå att skriva nettoreaktionen så för att indikera att B är en katalysator.
.jpg?width=800&upscale=false)
Jag vet inte riktigt vad som stör mig så mycket med detta betraktelsesätt... 🤔
Nu höftar jag bara lite, men skulle det vara möjligt att tolka vad en reaktion som denna betyder i termer av termodynamik? Låt oss säga att vi har ett system med tre species där vi känner entropifunktionen , och antag vidare att vi erhåller en förändring från jämviktstillstånd till jämviktstillstånd genom förändring av med fixerad volym och intern energi. Nedan finns en grafisk representation (saxad ur andra utgåvan av Callen) av systemets entropiyta med en tänkt slät kurva längs denna:
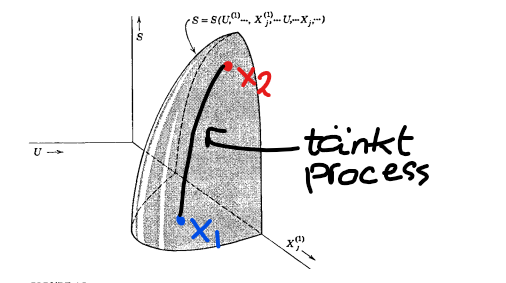
Låt säga att summan av de elementarreaktioner som orsakar förändringen är det vi på "kemispråk" skulle skriva . Kan vi ge någon termodynamisk tolkning av vad reaktionen betyder?
Tillägg: 1 feb 2026 03:06
*Jag försöker bara betrakta problemet ur lite olika perspektiv. Kanske något av dem funkar mentalt för mig. Jag känner att jag logiskt förstår men att känslan av förståelse är obefintlig...
Är inte mycket påläst inom termokemi då jag är bara en gymnasieelev, men om jag får killgissa så skulle den rena termodynamiska tolkningen vara att A och B minskar medan C ökar i ett visst förhållande.
Det säger ju oss fortfarande inget om vägen dit eller hur snabbt detta sker, utan bara att systemet går från ett tillstånd till ett annat med ökad entropi.
Orelaterat till din senaste fråga men bara en liten kommentar kring det du kallade för en svart låda. Ibland behövs såna "svarta lådor" õr att spara tid och gör saker enklare.
Jämför t.ex. alt. 1 och alt. 2 i esterreaktionen nedan. Dessa är två sätt för att beskriva exakt samma reaktion. Detta är ett ganska enkelt exempel (den enklaste karboxylsyran reagerar med den enklaste alkoholen). Det finns säkert mer komplexa reaktioner som kan delas i hur många intermediära reaktioner som helst. Men du kan se hur mycket längre alt. 2 är...
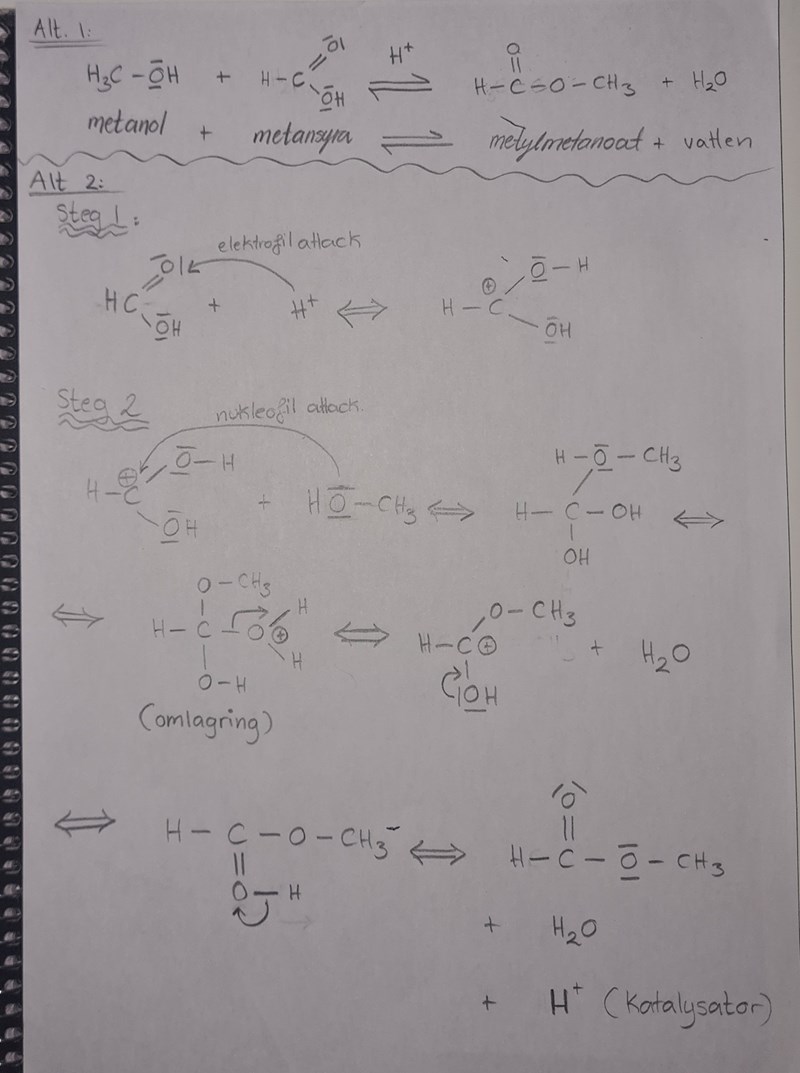
Att bara skriva formeln går supersnabbt men om man sska iställer visa alla pilar och steg som äger rum när ett ämne ska reagera och bilda ett annat tar det mycket längre tid. Ibland behöver man visa det, men i de allra flesta fallen räcker ddet gott o väl med reaktionsformeln.
Nu när jag har sovit lite på saken tror jag att jag är mer villig att köpa karaktäriseringen av kemiska reaktionsformler som "svarta lådor".
Om vi återgår till reaktionen
så tänker vi alltså att det finns en process inom vårt system som består av många olika typer av elementarsteg, och när processen har fullbordats är nettoeffekten på systemet att vätgas och kvävgas har konsumerats och ammoniak har bildats, i det stökiometriska förhållandet .


