Värmekapacitet
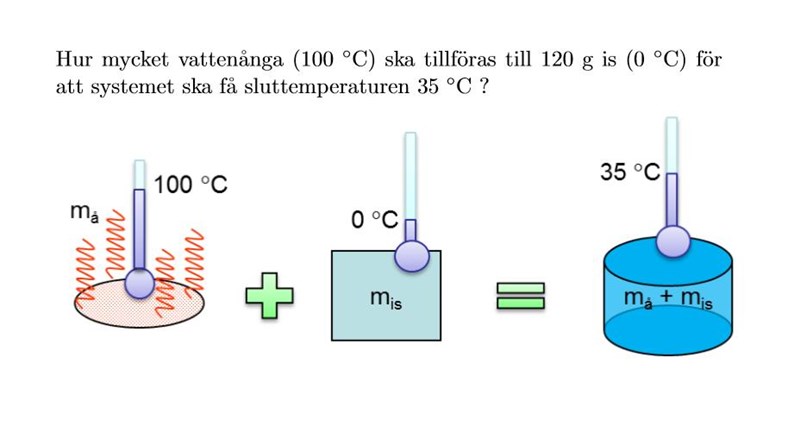 Hej, jag har fastnat i den här frågan. Jag vet att för att ångan ska kondensera (samma energi vid förångning) så avger den energi som vi kan ta reda på av en formel, osäker på vilken formel, (E=c*m*delta T) eller (Q=lå*m). Har testat båda men utan lycka. Sen har vi isen som ska smälta och få energi, sen ska vi summera båda och hitta sist massan för ångan. Jag vet inte hur ska jag göra. hjälp mig tack
Hej, jag har fastnat i den här frågan. Jag vet att för att ångan ska kondensera (samma energi vid förångning) så avger den energi som vi kan ta reda på av en formel, osäker på vilken formel, (E=c*m*delta T) eller (Q=lå*m). Har testat båda men utan lycka. Sen har vi isen som ska smälta och få energi, sen ska vi summera båda och hitta sist massan för ångan. Jag vet inte hur ska jag göra. hjälp mig tack
Visa hur du har försökt! Det står i Pluggakutens regler att du skall visa hur du har tänkt och hur långt du har kommit. /moderator
Du behöver beräkna hur mycket värme som tillförs när isen smälter, hur mycket värme som tillförs när det smälta vattnet värms från 0 till 35 grader, hur mycket värme som frigörs när g vattenånga kondenseras och hur mycket värme som frigörs när g vatten svalnar från 100 till 35 grader.
Smaragdalena skrev:Visa hur du har försökt! Det står i Pluggakutens regler att du skall visa hur du har tänkt och hur långt du har kommit. /moderator
Du behöver beräkna hur mycket värme som tillförs när isen smälter, hur mycket värme som tillförs när det smälta vattnet värms från 0 till 35 grader, hur mycket värme som frigörs när g vattenånga kondenseras och hur mycket värme som frigörs när g vatten svalnar från 100 till 35 grader.
Jag har ju skrivit redan att mina försök blev fel och jag skrev också hur jag hade tänkt. ville veta om jag hade tänkt rätt! och ifall inte vart är felet! jag har inte postat bara frågan.
första steget är att beräkna energin som avges vid kondensationen (Qå = lå ·må) där lå = 2260 kJ/kg.
Men jag vet inte massan på ångan, hur ska jag hitta Qå med bara lå värde??
R.i.Al skrev:första steget är att beräkna energin som avges vid kondensationen (Qå = lå ·må) där lå = 2260 kJ/kg.
Men jag vet inte massan på ångan, hur ska jag hitta Qå med bara lå värde??
Det är ju det som hela frågan går ut på. Du kan inte använda en enskild formel här och bara sätta in siffror och få ett svar. Använd att energin är bevarad (d.v.s. ingen energi läcks ut när detta händer) och då kan du hitta sambanden du behöver.
Vad händer när ångan möter isen? Och vad händer när isen möter ångan? (tips: Någon "avger" och en annan "tar upp" energi)
Om du bara skriver att det har blivit fel har vi ingen chans att hjälpa dig att hitta var det har gått fel. Vi som svarar här är bra på fysik, men usla på tankeläsning.
Räkna ut de fyra värmemängderna jag skrev om i mitt förra inlägg. I två av dem kommer variabeln att ingå. Du vet att det behöver tillföras lika mycket värme för att smälta isen och värma det vattnet till temperaturen 35 grader, som det avges när ångan kondenseras och det vattnet svalnar till 35 grader. Du kan alltså räkna fram ett värde på .
woozah skrev:R.i.Al skrev:första steget är att beräkna energin som avges vid kondensationen (Qå = lå ·må) där lå = 2260 kJ/kg.
Men jag vet inte massan på ångan, hur ska jag hitta Qå med bara lå värde??
Det är ju det som hela frågan går ut på. Du kan inte använda en enskild formel här och bara sätta in siffror och få ett svar. Använd att energin är bevarad (d.v.s. ingen energi läcks ut när detta händer) och då kan du hitta sambanden du behöver.
Vad händer när ångan möter isen? Och vad händer när isen möter ångan? (tips: Någon "avger" och en annan "tar upp" energi)
Kan inte förstå bara av teorin. Jag hade själv beräknat energin som behövs för att smälta isen (E=333*0.12=39.96 KJ) och sedan energin som behövs för att värma upp vattnet (E=4190*0.12*35=17.598 KJ) har summerat E totalt (57.558 KJ) och lagt i formeln(m=57,558/2260) som beskriver massan för ångan men får bara fel svar som jag sa i början. svaret ska vara 22.7 g. hur kom de till det???
Smaragdalena skrev:Om du bara skriver att det har blivit fel har vi ingen chans att hjälpa dig att hitta var det har gått fel. Vi som svarar här är bra på fysik, men usla på tankeläsning.
Räkna ut de fyra värmemängderna jag skrev om i mitt förra inlägg. I två av dem kommer variabeln att ingå. Du vet att det behöver tillföras lika mycket värme för att smälta isen och värma det vattnet till temperaturen 35 grader, som det avges när ångan kondenseras och det vattnet svalnar till 35 grader. Du kan alltså räkna fram ett värde på .
Jag har inte skrivit bara det blev fel. Jag skrev hur jag har tänkt och löst det, du kan gå upp igen och se det. Jag gjorde beräkningar utav min tanke sätt och sa att det blir bara fel. så jag väntade att ni ska förklara åt mig vad är felet i mitt tankesätt eller vad är det som fattas. Jag höll på frågan sen igår och sömnade på boken, till slut bestämde jag att få hjälp av någon här men det visar sig att det kommer ta en dag till tills jag får lite hjälp. Jag söker ingen direkt svar av er, jag söker bara förståelse. Jag har svaret i facit.
Om du visar hur du har gjort tydligare, så är det läggare att hjälpa dig. Det verkar som om du inte räknar med den energi som frigörs när vattnet svalnar, men det är svårt att veta ordentligt när du redovisar så bristfälligt.
Kalla massan vattenånga för .
Hur mycket energi frigörs det om gram vattenånga kondenseras?
Hur mycket energi frigörs om gram 100-gradigt vatten svalnar till 35 grader?
Summan av dessa båda bidrag skall vara lika med 57.558 KJ. Vilket värde på ger detta?
Jag fattar ej hur går jag vidare. Jag trodde att energin som isen behöver för att smälta (39.96 kJ) är densamma energin som ångan avger för att omvandlas till vatten. Därför tog jag det och delade med Lå=2260 för att hitta massa men det blev fel massa.

För tredje gången: Det frigörs värme inte bara när ångan kondenseras, utan även när det 100-gradiga vattnet svalnar till 35 grader.
Läs igenom hela tråden, följ de råd du får, visa hur du räknar och du kommer att få hjälp tills du är klar. Strunta i de råd du får, och åtminstone jag kommer att tröttna på att försöka hjälpa dig.
Smaragdalena skrev:För tredje gången: Det frigörs värme inte bara när ångan kondenseras, utan även när det 100-gradiga vattnet svalnar till 35 grader.
Läs igenom hela tråden, följ de råd du får, visa hur du räknar och du kommer att få hjälp tills du är klar. Strunta i de råd du får, och åtminstone jag kommer att tröttna på att försöka hjälpa dig.
Tack för din artighet.
Jag vet att det första energin avges från ångan vid avkylning, men det som jag sa flera gånger att jag får bara fel svar! I min andra kommentar frågade jag (hur ska jag hitta Qå med bara lå värde) ?? Du svarade ej om det är Etot eller bara E1. Jag går steg för steg och ville räkna ut energin som avges vid avkylning från 100 till 0 och sen uppvärmning från 0 till 35 men Du säger ingenting om jag tänker rätt eller om det är fel varför fel. Jag sa jag söker förståelse och inte svar.
Jag är ingen fysik lärare, om jag inte hade svårt med det så skulle du inte se mig här. Tröttnar du av att avge energi för att hjälpa mig, så tvingar jag inte dig. Det finns andra som kan ha mer tålamod för mig och andra som har svårigheter som mig.
Kan du vara snäll och länka till det inlägg där du har beräknat hur mycket värme som frigörs när gram vatten svalnar 65 grader, för jag kan inte hitta det - men jag sitter med mobilen just nu och har lite dålig översikt av tråden.
Smaragdalena skrev:Kan du vara snäll och länka till det inlägg där du har beräknat hur mycket värme som frigörs när gram vatten svalnar 65 grader, för jag kan inte hitta det - men jag sitter med mobilen just nu och har lite dålig översikt av tråden.
Jag tror du läste inte vad jag skrev sist. Jag sa jag gick steg för steg. har förklarat i min tråd att jag får fel svar, utan att visa mina beräkningar på papper eftersom allt är fel. Jag sade i min tredje kommentar (((har summerat E totalt (57.558 KJ) och lagt i formeln(m=57,558/2260) som beskriver massan för ångan men får bara fel svar som jag sa i början. svaret ska vara 22.7 g. hur kom de till det?))) Efter det sa du ((Summan av dessa båda bidrag skall vara lika med 57.558 KJ. Vilket värde på x ger detta?)) Så du säger det är rätt Etot men frågar mig hur ska jag hitta värdet på x. Jag sa ju fick fel. Om jag vet vad som är felet så skulle jag inte posta tråd här och förlora tid utan nytta. Du ger hjälp i en dropp-pipett utan en god förklaring till en "student hjärna".
Du är på rätt spår!
Smaragdalena har skrivit det ett flertal gånger, men jag gör ett försök i att illustrera nästa steg. Den totala energin som krävs för att smälta isen till vatten, samt värma vattnet till 35 grader C är, som du kommit fram till, ≈ 57 558 J. Denna energi, när ångan och isen blandas, avges till isen. Den energi som behöver upptas av isen är således 57 558 J, eller hur?
Nu vill vi beräkna hur mycket kg vattenånga som behövs. För att omvandla 100 grader C ånga till 100 grader C vatten gäller:
E1 = cå * m. Vi vet cå = 2260 kj, antag massan m. --> 2260000*m
Dessutom har vi energin då vatten går från att vara 100 grader C till 35 grader C, skillnaden i temperatur = 65 grader C.
E2 = cv * m * delta T, c (vatten) = 4,18 kj / (kg * K). Massan m förblir oförändrad. Detta ger 4180 * m * 65 ---> 271 700*m
Nu har vi Etot = E1 + E2.
57 558 J = 2260000*m + 271 700*m
Lös ekvationen och se vad du får för svar :)
//PluggaSmart
Det är svårt att hjälpa dig, eftersom du inte vågar dela med dig av hur du har tänkt, utanlåter mig försöka gissa hur du har tänkt. Jag kan mycket om fysik, men jag är för det mesta ganska usel som tankeläsare.
Gör nu steg för steg:
- Beräkna hur mycket energi som upptas när 120 g is smälter. (Detta har du gjort.)
- Beräkna hur mycket energi som upptas när 120 g vatten värms 35 grader, från 0 till 35. (Detta har du gjort).
- Beräkna hur mycket energi som frigör när gram vattenånga kondenseras. (Detta kan jag inte hitta att du har gjort någonstans.)
- Beräkna hur mycket energi som frigörs när gram vatten kyls ner 65grader, från 100 till 35. (Detta kan jag inte hitta att du har gjort någonstans.)
Summan av energierna 1+2 skall vara lika med energierna 3+4. Gör en ekvation och beräkna , d v s hur många gram vattenånga som behövs.
Nu vill vi beräkna hur mycket kg vattenånga som behövs. För att omvandla 100 grader C ånga till 100 grader C vatten gäller:
E1 = cå * m. Vi vet cå = 2260 kj, antag massan m. --> 2260000*m
Varför räknar du att massan ska vara i kg och multiplicerar 2260 med 1000? I facit är massan i gram.
2260 kj = 2260 * 10^3 J = 2260000J
SI-enheten för massa är kg.
//PluggaSmart
3. Beräkna hur mycket energi som frigör när x gram vattenånga kondenseras. (Detta kan jag inte hitta att du har gjort någonstans.)
Det har jag försökt lösa, du ser det i bilden på mitt block. Jag har även innan skrivit i min kommentar att för att räkna ut den energin jag fick detta samband (E=Lå*Må) och jag frågade hur löser jag den när jag bara har värdet på Lå? Men du svarade inte. Har varken massa eller E känd. Har testat även med E1 men fick fel svar. Det är den här delen som jag fastnade i från början.
Om du har smältvärme och ångbildningsvärme i enheten kJ/kg och specifik värmekapacitet i enheten kJ/kgK så blir det precis samma siffror om du använder enheterna J/g respektive J/gK istället. Oftast föredrar man att arbeta med SI-enheter, men det funkar på många andra sätt också - det gäller bara att vara konsekvent och inte blanda olika enheter hur som helst.
PluggaSmart skrev:Du är på rätt spår!
Smaragdalena har skrivit det ett flertal gånger, men jag gör ett försök i att illustrera nästa steg. Den totala energin som krävs för att smälta isen till vatten, samt värma vattnet till 35 grader C är, som du kommit fram till, ≈ 57 558 J. Denna energi, när ångan och isen blandas, avges till isen. Den energi som behöver upptas av isen är således 57 558 J, eller hur?
Nu vill vi beräkna hur mycket kg vattenånga som behövs. För att omvandla 100 grader C ånga till 100 grader C vatten gäller:
E1 = cå * m. Vi vet cå = 2260 kj, antag massan m. --> 2260000*m
Dessutom har vi energin då vatten går från att vara 100 grader C till 35 grader C, skillnaden i temperatur = 65 grader C.
E2 = cv * m * delta T, c (vatten) = 4,18 kj / (kg * K). Massan m förblir oförändrad. Detta ger 4180 * m * 65 ---> 271 700*m
Nu har vi Etot = E1 + E2.
57 558 J = 2260000*m + 271 700*m
Lös ekvationen och se vad du får för svar :)
//PluggaSmart
Hade problem med inloggningen men tack jag löste den..